-
排水管道是城市的重要基础设施,其空间相对封闭,空气流通较差,易形成厌氧环境。在厌氧条件下,管壁生物膜中的硫酸盐还原菌(SRB)可将污水中的
${\rm{SO}}_4^{2 - }$ 还原为S2−,并在水解作用下进一步形成HS−和H2S[1-4],这三者的总浓度通常大于10 mg·L−1[3,5],给污水管道的安全运行和周围环境带来严重的负面效应。H2S气相组分在扩散至管道气相空间后,会在管顶生物膜中硫氧化菌的作用下转化为硫酸,从而腐蚀混凝土管道[6],腐蚀速率可达10 mm·a−1[7-8]。H2S的毒性较强,在空气中浓度达到32.37~64.74 μg·L−1时,会造成工作人员中毒,甚至引发伤亡事件。部分硫化氢气体会通过检查井等设施扩散至外界,释放难闻的气味,影响居民的正常生活[9]。此外,污水中的S2−会抑制硝化细菌的活性,从而影响后续污水处理工艺的生物脱氮效果[10]。根据主要的作用机理,对污水管道中H2S气体的控制措施[11-12]主要分为4类:提高污水的氧化还原电位,抑制SRB的硫酸盐还原活性,如鼓风通气技术[13-14]、投加硝酸盐或亚硝酸盐等[15-17];将已产生的S2−沉淀去除,如投加二价铁盐和三价铁盐等[18-19];提高污水的pH,降低液相中H2S分子的占比,减少H2S向气相的释放,如投加Mg(OH)2等[20];灭活管壁上的生物膜,降低S2−产率,如投加大量NaOH(提高pH至10~12)[21]、投加生物抑制剂等[22]。
SRB广泛分布于管道生物膜的表层与内部,渗透性能差的化学药剂难以对生物膜内部的SRB产生抑制作用。在抑制SRB活性的化学药剂中,硝酸盐在生物膜中的渗透性能更强,能够同时抑制生物膜表层与内部的SRB,降低SRB的硫酸盐还原活性[23]。此外,硝酸盐能够通过化学氧化和微生物的代谢作用去除已有的S2−等物质。鉴于上述优势,在控制污水管道腐蚀及H2S气体产生方面,硝酸盐已得到了广泛的应用。经过数十年的研究,学者们[15,23-28]在硝酸盐控制H2S气体的原理、效果与缺陷等方面取得了大量的研究成果。本文综述了近年来在排水管道中应用硝酸盐控制S2−的研究进展,介绍了硝酸盐的控制机理,分析了控制效果及相关的影响因素,同时对硝酸盐的消耗规律及其耗尽后SRB活性的恢复,硝酸盐对生物相的影响进行了总结,最后根据研究成果及所存在的问题对如何提高控制效果,减少副产物的产生提出一些建议和思考。
全文HTML
-
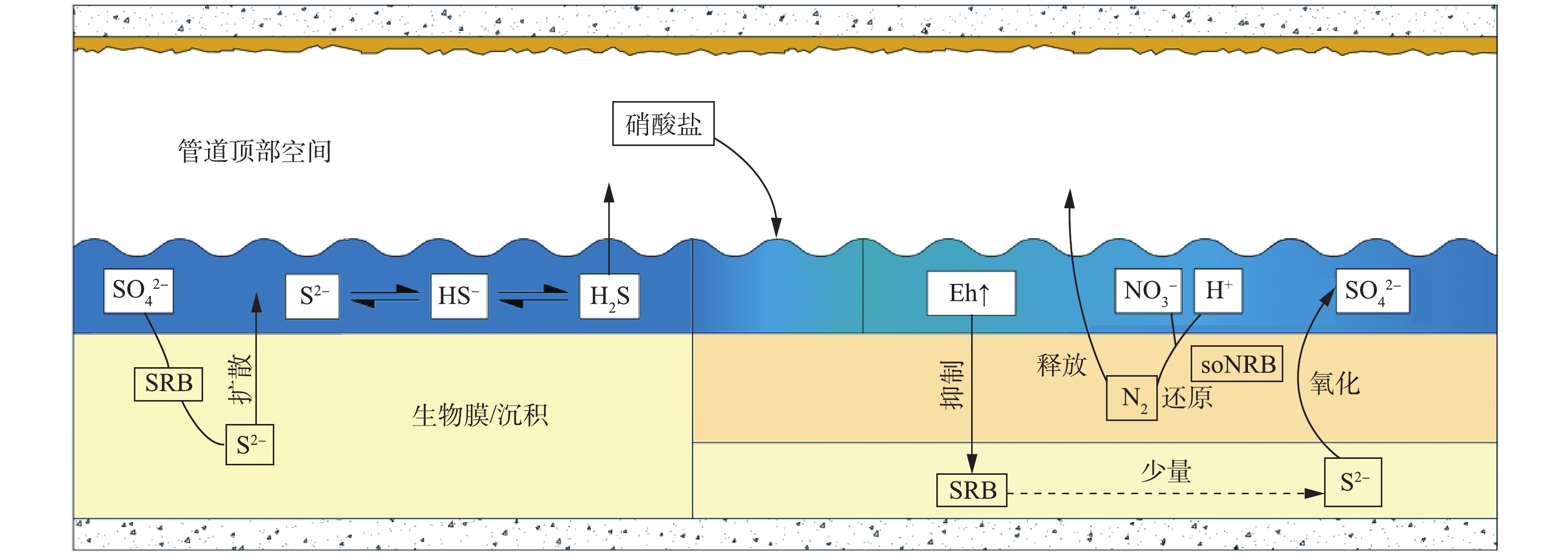
生活污水进入污水管道之后,溶解氧在微生物的新陈代谢作用下被大量消耗,使管内形成厌氧状态,兼性厌氧菌SRB成为优势菌属。如图1所示,SRB能够利用有机物作为电子供体,将扩散至生物膜内的
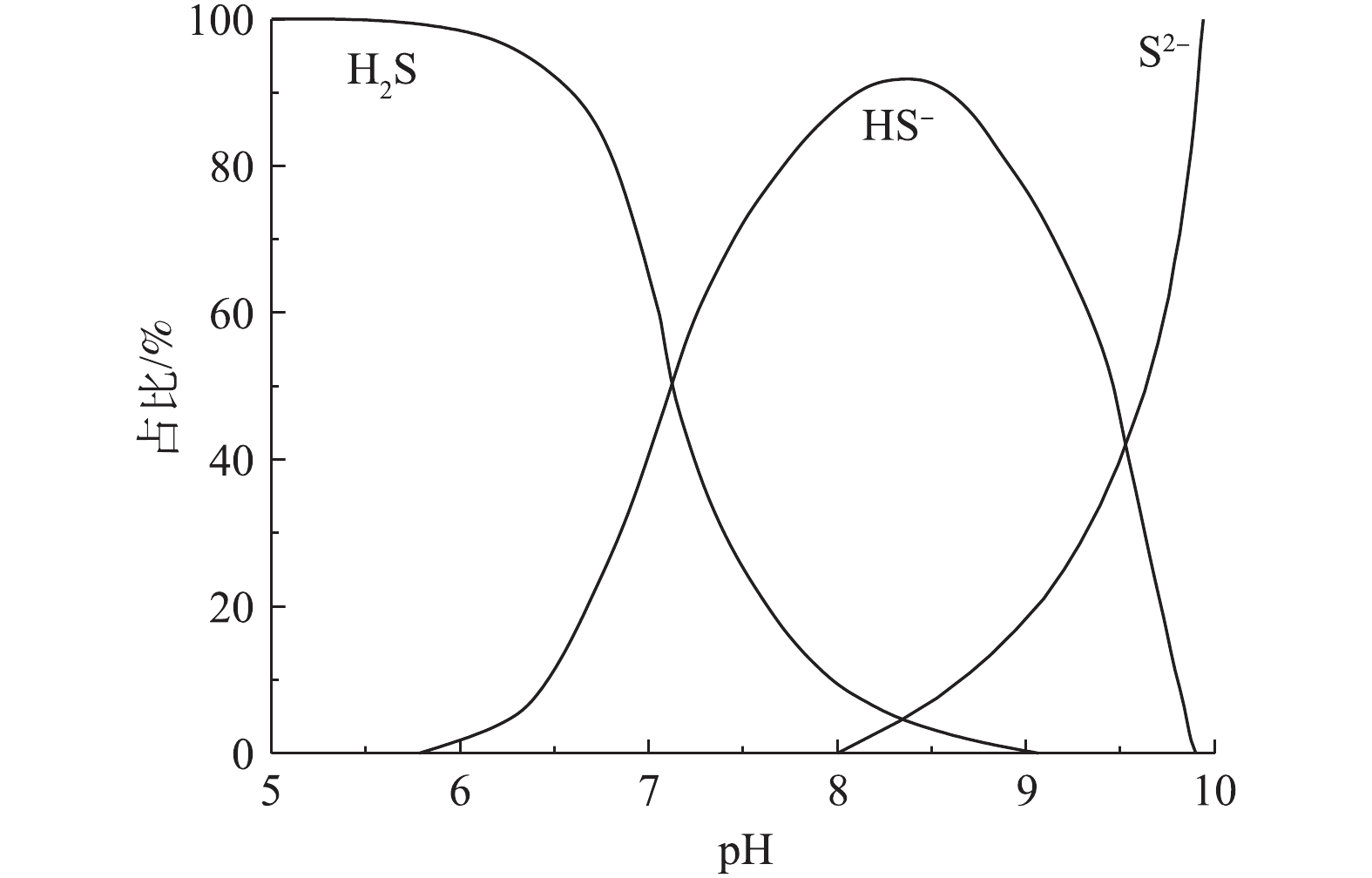
${\rm{SO}}_4^{2 - }$ 还原为S2−,并进一步水解形成HS−和H2S,只有分子形态的H2S才能从液相释放到气相中[12]。气相中的H2S分子经气液传质和扩散进入管顶生物膜,在硫氧化菌的新陈代谢作用下,被转化为硫酸等具有腐蚀性的物质,从而腐蚀混凝土管道。在水力停留时间较长的情况下,污水中的有机物被大量降解,导致pH下降,促进H2S分子的占比大幅上升,使更多H2S释放至管顶气相空间[29],转化为硫酸,腐蚀管道或释放到外界环境中。 -
厌氧环境是SRB还原
${\rm{SO}}_4^{2 - }$ 的必要条件[30],只有在氧化还原电位(Eh)低于−320 mV时,SRB才能以较快的速率还原${\rm{SO}}_4^{2 - }$ ,进而释放S2−[31]。而硝酸盐能够有效提高污水的Eh,破坏污水的厌氧状态,并将其转化为缺氧状态,通过对SRB的繁殖速率及其硫酸盐还原活性的抑制,实现对S2−的控制[32]。如图1所示,除直接抑制SRB之外,硝酸盐还能够促使生物膜表层的硫氧化-硝酸盐还原菌(soNRB)大量繁殖,如脱氮硫杆菌(Thiobacidenitrificans)、脱硫硫杆菌(Thiomicrospira denitrificans)和脱氮副球菌(Thiosphera pantotropha)等[24]。soNRB可以利用硝酸盐将S2−、HS−和H2S氧化为单质硫(S0)或
${\rm{SO}}_4^{2 - }$ ,较高的氧化速率(达${\rm{SO}}_4^{2 - }$ 和S0还原速率的20~30倍)使其能够去除已形成的S2−[33]。根据菌种的不同,S2−、HS−和H2S的氧化分为2种途径:在S2−被氧化为单质硫之后,由其他soNRB将单质硫进一步氧化为${\rm{SO}}_4^{2 - }$ ,反应过程[34]如式(1)和式(2)所示;由单一菌种直接将S2−、HS−和H2S氧化为${\rm{SO}}_4^{2 - }$ 。单质硫的低溶解度使其氧化速率较低,约为S2−的15%,这就导致大量未被氧化的单质硫积累于生物膜内[33]。soNRB在氧化S2−的同时会消耗氢离子,提高污水pH至7.9~8.3[27]。pH的提高使得污水中H2S分子的占比降至5%左右[12](图2),可大幅地减少H2S向管顶气相空间的释放,而HS−占比的上升则会促进soNRB的硫氧化活性(HS−更易被soNRB氧化),进而提高硝酸盐的控制效果[29]。在S2−耗尽后,soNRB能够利用硝酸盐,通过异养反硝化维持活性,使其能够在S2−再次出现时,有较高的硫氧化速率。异养反硝化过程[35]如式(3)所示。除此之外,硝酸盐也能够通过化学作用,直接将S2−氧化为
${\rm{SO}}_4^{2 - }$ ,该过程[36]如式(4)所示。但S2−的化学氧化效率较低,仅为生物代谢作用的7.8%[27]。
1.1. 污水管道中硫的转化
1.2. 硝酸盐控制硫的原理
-
在实验室实验[15,27-28,33,37-38]与现场实验[24,35,39]中,仅须投加30 mg·L−1的
${\rm{NO}}_3^ - $ -N就能将S2−控制在2 mg·L−1以下,且S2−的去除率可达80%以上(见表1和表2)。有研究显示,加药前,S2−的浓度、硝酸盐的投加量和投加方式是控制效果的主要影响因素,控制效果主要以S2−的去除量、S2−的去除率和硝酸盐利用率(单位${\rm{NO}}_3^ - $ -N去除S2−的量)来表征。如表1和表2所示,加药前,S2−浓度的升高会提高硝酸盐的利用率,但会导致S2−去除率的降低;硝酸盐投加量的增加会提高S2−的去除率,但会导致硝酸盐利用率的降低;与持续投加相比,间歇投加能够提高硝酸盐利用率,但控制效果有小幅下降[37],而在下游(出水口前端)投加能够大幅提高控制效果,但硝酸盐利用率有小幅下降[38]。 -
LIU等[37]和YANG等[26]的研究显示,S2−的转化速率会随着
${\rm{NO}}_3^ - $ -N与S2−质量比(g : g)的降低和pH的升高而显著提高(见表3)。${\rm{NO}}_3^ - $ -N与S2−质量比的最佳范围为(0.5 : 1)~(0.6 : 1)[37],略高于硝酸盐将S2−氧化为单质硫(S0)的理论${\rm{NO}}_3^ - $ -N与S2−质量比(0.18 : 1)~(0.44 : 1)[12],这与加药后单质硫与${\rm{SO}}_4^{2 - }$ 同时出现的现象相符。
2.1. 控制效果及其影响因素
2.2. S2−转化速率的影响因素
-
排水管道中硝酸盐的转化与污水处理中的反硝化过程类似,同样包含2个步骤,即硝酸盐被还原为亚硝酸盐,进而被还原为氮气[41]。亚硝酸盐为硝酸盐转化过程中的中间产物,同样具有控制管道内H2S气体的能力,因此,本文亦讨论亚硝酸盐消耗规律的相关研究进展。
-
有研究[42]显示,硝酸盐的消耗速率与其浓度呈正相关,其规律类似于莫诺方程,不同浓度下的硝酸盐消耗速率可表示为式(5),亚硝酸盐消耗速率的规律与硝酸盐相同(见式(6))。
式中:N1为
${\rm{NO}}_3^ - $ -N消耗速率,mg·(L·h)−1;N2为${\rm{NO}}_2^ - $ -N消耗速率,mg·(L·h)−1;N1max为${\rm{NO}}_3^ - $ -N最大消耗速率,mg·(L·h)−1;N2max为${\rm{NO}}_2^ - $ -N最大消耗速率,mg·(L·h)−1;$K_{{\rm{NO}}_3} $ 为${\rm{NO}}_3^ - $ -N消耗速率半饱和常数,取0.76 mg·L−1;$K_{{\rm{NO}}_2} $ 为${\rm{NO}}_2^ - $ -N消耗速率半饱和常数,取0.33 mg·L−1;$S_{{\rm{NO}}_2} $ 为${\rm{NO}}_2^ - $ -N浓度,mg·L−1;$S_{{\rm{NO}}_3} $ 为${\rm{NO}}_3^ - $ -N浓度,mg·L−1。 -
有研究[42-43]表明,硝酸盐浓度的衰减为先快后慢的变化趋势,在此过程中存在拐点,拐点多出现在初始浓度的10%~20%处。硝酸盐的消耗会促使亚硝酸盐逐渐积累,其浓度峰值与硝酸盐浓度下降的拐点大多同时出现。根据这一规律,ABDUL-TALIB等[43]在消耗速率模型[42]和排水管道污水厌氧转化模型(WATS模型)[44]的基础上开发出了硝酸盐浓度衰减动力学模型,这一模型能够根据硝酸盐的消耗速率和污水的水力停留时间估算硝酸盐的剩余浓度,确定硝酸盐的投加量等控制参数,指导实践。该模型[43]如式(7)和式(8)所示。
式中:
$S_{\rm{NO}_3} $ 为${\rm{NO}}_3^ - $ -N浓度,mg·L−1;$S_{\rm{NO}_2} $ 为${\rm{NO}}_2^ - $ -N浓度,mg·L−1;XBw为活性微生物量(以COD表征),mg·L−1;$\mu_{{\rm{HNO}_3}({\rm{I}})} $ 为第1阶段中硝酸盐还原菌的最大增殖速率,d−1;$\mu_{{\rm{HNO}_2}({\rm{I}})} $ 为第1阶段中亚硝酸盐还原菌的最大增殖速率,d−1;$\mu_{{\rm{HNO}_2}({\rm{II}})} $ 为第2阶段中亚硝酸盐还原菌的最大增殖速率,d−1;$K_{{\rm{NO}_3}({\rm{I}})} $ 为第1阶段中硝酸盐的半饱和常数,mg·L−1;$K_{{\rm{NO}_3}({\rm{II}})} $ 为第2阶段中硝酸盐的半饱和常数,mg·L−1;$K_{{\rm{NO}_2}({\rm{I}})} $ 为第1阶段中亚硝酸盐的半饱和常数,mg·L−1;$K_{{\rm{NO}_3}({\rm{II}})} $ 为第2阶段中亚硝酸盐的半饱和常数,mg·L−1;YH为缺氧状态下微生物的生长常数。
3.1. 硝酸盐/亚硝酸盐的消耗速率
3.2. 硝酸盐/亚硝酸盐浓度的衰减规律
-
硝酸盐会改变管道中微生物的群落结构,并由此实现对S2−的控制。有研究表明,硝酸盐对微生物的影响主要有3种表现形式:生物膜纵深方向上的变化[15,23,28];微生物群落结构的变化[38];SRB与soNRB之间的竞争/协同关系[15,23,27]。
-
污水中各组分在生物膜内的渗透深度不同(
${\rm{COD}} > {\rm{SO}}_4^{2 - } > {\rm{NO}}_3^ - $ ),这就导致生物膜内出现生物相分层的现象[15](见图3)。在加药前,硫酸盐还原区域主要位于生物膜表面0~500 μm处的厌氧区,产甲烷区域则在500 μm以下[23]。投加硝酸盐后,生物膜内各个功能区域的位置和深度均会发生改变,由表面至内部分别为硫氧化区域(soNRB氧化S2−的主要区域)、硫酸盐还原区域和产甲烷区域,分别位于表面以下0~700 μm处、600~1 000 μm处、小于900 μm处。在长期加药之后,各组分的渗透深度大幅降低,${\rm{NO}}_3^ - $ 从700 μm降至350 μm,${\rm{SO}}_4^{2 - }$ 则从1 000 μm降至500 μm,各区域的位置也会随之变化[15]。在重力管底的沉积物中同样存在生物相分层现象。实验结果表明,在加药前,硫酸盐还原区域主要集中于沉积表层0~200 μm处,产甲烷区域则位于表层以下0~2 cm处[28]。投加硝酸盐后,表层以下4~6 mm处形成硫氧化区域,硫酸盐还原区域降至6~10 mm处,产甲烷区域则转移至1~2.5 cm处[28]。
-
有研究[38]表明,soNRB中的β-变形菌受硝酸盐影响最大,其中Simplicispira、丛毛单胞菌(Comamonas)、Azonexus和Thauera[45]的相对丰度增加趋势较为明显,分别从0.6%、0.2%、0.3%和1.1%升高至33.3%、6.4%、5.4%和5.1%[38]。此外,能够将S2−氧化为单质硫(S0)的兼性厌氧菌Dechloromonas agitata[46]的相对丰度也从0.5%升高至3.1%[38]。除soNRB外,甲烷氧化菌也有显著增加,甲基杆菌属whittenburyi 1521号[47]和甲基微菌属BG8[48]的相对丰度从0%升高至1.8%[38]。与soNRB和甲烷氧化菌相反,SRB的相对丰度大幅降低,δ-变形菌属从8.4%降至1.3%[38]。产甲烷菌受硝酸盐影响不大,不过各菌属占比均有小幅变动,甲烷细菌属由6.6%降至1.1%,甲烷丝菌属则由93.1%升高至98.8%[38]。
-
在硝酸盐的影响下,生物膜内的soNRB大量繁殖,soNRB对有机物的竞争[49]减少了SRB可利用的有机物,使得S2−的产率有所下降[23]。除竞争关系外,SRB和soNRB之间也存在着协同关系,soNRB对S2−的消耗会提高SRB的硫酸盐还原活性。有研究[15,27]表明,投加硝酸盐一段时间之后,S2−的产率分别从3.8 mg·(L·h)−1和6 mg·(L·h)−1增加至5.0 mg·(L·h)−1和12 mg·(L·h)−1,上升幅度分别为57.9%和100%。如果可以利用两者的竞争关系,弱化协同关系,就能够提高控制效果,从而降低加药量。
4.1. 生物群落的生物相分层
4.2. 生物群落结构的变化
4.3. SRB与soNRB间的竞争/协同作用
-
硝酸盐不会灭活SRB,但会抑制其硫酸盐还原活性。硝酸盐耗尽后,SRB的硫酸盐还原活性会逐渐恢复,S2−再次出现于污水中[28]。此外,由于soNRB氧化S2−和单质硫(S0)的速率不同[33],部分S2−转化为亚微米级至微米级的硫单质(S0)[50]并积累于生物膜中[15]。在硝酸盐耗尽后,这部分单质硫会被硫(S0)还原菌还原为S2−并释放至污水中,使S2−浓度超过加药前水平[15,33]。为解决这一问题,研究人员向管道中投加数倍于原剂量的硝酸盐,但加药量的增加又会引发水质变化问题。
-
投加硝酸盐一段时间之后,生物膜内的soNRB大量繁殖,导致硝酸盐消耗速率大幅增加。为防止硝酸盐耗尽后SRB恢复活性,需药量也随之增加[15,27]。有研究[24,27]表明,每增加30 mg·L−1的
${\rm{NO}}_3^ - - {\rm{N}}$ 就会增加120~150 mg·L−1易降解COD的消耗[27],增加污水厂进水硝态氮3 mg·L−1,亚硝态氮6 mg·L−1[24],反硝化过程中的总氮负荷也随之增加。易降解有机物为污水处理中脱氮的重要碳源,碳源的减少与总氮负荷的增加会降低污水处理的脱氮效果,为使出水达标,常需人工投加碳源。 -
利用硝酸盐控制S2−会导致温室气体N2O的积累和释放[28,38,51],其温室效应是CO2的296倍[52]。N2O产生的主要原因是soNRB的N2O还原活性被二价硫(S2−、HS−和H2S)抑制[53],但是否为直接抑制尚有争议。部分学者[54-55]认为直接抑制剂是H2S分子,但也有研究[53]表明,直接抑制剂为S2−,因为S2−会将N2O还原酶所需的铜沉淀,从而降低soNRB的N2O还原速率。因此,须进一步研究以确定还原N2O的直接抑制剂。
除N2O之外,硝酸盐的投加还会导致二甲基三硫化物(DMTS)的产生[56]。DMTS的气味阈值浓度(OTC)极低,仅为10 ng·L−1[57],是排水管道内的主要气味物质之一。DMTS主要来源于soNRB中假单胞菌[58]代谢产生的单质硫(S0)与S2−结合形成的多硫化物(
${\rm{S}}_n^{2 - }$ )[59]。在甲基转移酶的作用下,多硫化物(${\rm{S}}_n^{2 - }$ )被转化为DMTS。此外,有机硫物质的降解和S2−的甲基化也是DMTS形成的重要途径[60-61]。
5.1. 硝酸盐耗尽后SRB活性的恢复
5.2. 过量加药所引发的水质变化
5.3. 控制副产物
-
1)硝酸盐氧化S2−的速率与污水的pH呈正相关,与
${\rm{NO}}_3^ - $ -N和S2−的质量比呈负相关。可以根据这一规律对硝酸盐的投加方式和投加浓度等参数进一步优化,提高硝酸盐的控制效果并降低加药量,减少水质变化对污水厂运行的影响。soNRB与SRB之间具有竞争关系和协同关系,如果能够强化两者的竞争关系,弱化协同关系,应当能够进一步提高硝酸盐的控制效果。2) N2O和DMTS是2种重要的控制副产物,对环境具有负面影响,但其负面影响没有具体量化。因此,在应用硝酸盐控制S2−的同时,还应对其造成的负面影响进行具体量化,如投加一定浓度硝酸盐所导致的温室效应等,探究副产物的控制方法及其效果和缺陷,形成能够指导实践的理论。此外,是否还有其他副产物也需要开展进一步的研究,如硝酸盐与含硫物质在作用过程中形成的中间产物等。
3)硝酸盐浓度衰减动力学模型有待完善,该模型主要通过soNRB的硝酸盐消耗速率来模拟硝酸盐浓度的变化,但soNRB利用硝酸盐氧化不同物质的速率有所不同,生物膜厚度、污水的流速等参数对有机物、硝酸盐和硫酸盐的扩散有一定影响,生物膜内的生物量则对大分子有机物的水解、S2−等物质的产量有一定影响,所以动力学模型还应在以上几个方面进一步优化。此外,这一动力学模型还未完全整合到WATS中,因为这一模型与缓流水体的实际情况更为贴合,还须对其进行调整,整合到WATS中。
4)实验室中用于模拟排水管道的反应器与实际排水管道所处的环境、水力条件等都有所不同,还须在实际排水管道中进行大量验证性的中试实验以确定硝酸盐不同应用方式的实际效果。



 下载:
下载: