-
进入环境的微塑料会导致生物链破坏等一系列环境问题,严重影响生态系统的稳定性和人类健康。微塑料(microplastics,MPs),通常指粒径小于5 mm的塑料颗粒,是近年来新兴环境污染物研究的热点对象之一[1]。虽然现场研究中记录的MPs的尺寸范围相对较广,但目前大多数实验室研究通常在较小的尺寸范围内使用纳/微塑料(N/MPs),介于纳米和亚微米之间[2-4]。即使在小范围内,获得的N/MPs的生态毒理学数据也显示出一些差异。一般认为,粒径越小的N/MPs,其生物利用度越高,保留时间越长,对生物群的毒性越大[5]。
由于微纳米塑料污染是环境领域的一个新兴问题,许多基础研究问题仍有待解决,现有的研究大多局限于微塑料在生物体内的积累,在河口区采集的23%野生海鲶和7.9%的石首鱼体内均检测到微塑料[6-7]。但有关微塑料对微生物生态影响的研究还较少,已有研究表明,塑料在海洋环境里能作为载体供微生物附着生长,由于塑料的疏水性,其表面可有利于微生物生物膜的形成[8]。MPs影响微生物群落的结构和功能,进而导致MPs的物理和化学性质的改变。NEGORO[9]解析了由壤霉菌属nylC编码的尼龙寡聚物水解酶的晶体结构并证明四倍体突变体能水解多聚尼龙,但尼龙水解酶是否能在合适的时间段内大量分解PA还需证明。YANG等[10]发现聚苯乙烯饲喂的黄粉虫幼虫粪便中PS长链发生解聚,证明了肠道微生物对PS分解起主要作用,分离出一株能以PS为唯一碳源的微小杆菌Exiguobacterium sp.YT2,在液体培养60 d能降解7.4%±0.4%的聚苯乙烯。然而,污水处理过程中微塑料对好氧反硝化脱氮效果的研究还很少,其对好氧反硝化污泥的影响机制尚待探讨。因此,本研究以反硝化污泥作为接种源,富集筛选好氧反硝化菌群,以60 nm聚苯乙烯(PS)和37~74 μm聚酰胺(PA)作为模型微塑料污染物,旨在研究微塑料对好氧反硝化菌群脱氮特性及反硝化相关基因表达的影响,为好氧反硝化菌在污水处理厂中的应用提供理论依据。
全文HTML
-
本研究所用接种污泥取自于江西省南昌市泉岭垃圾焚烧发电厂的渗滤液处理的反硝化污泥。富集培养基/驯化测试培养基:CH3COONa 3.28 g·L−1、NH4Cl 0.38 g·L−1、KNO3 1 g·L−1、KH2PO4 0.1 g·L−1、K2HPO4 0.168 g·L−1、MnSO4·7H2O 0.1 g·L−1、CuSO4 0.1 mg·L−1、CaCl2 0.01 g·L−1、FeSO4·7H2O 0.006 g·L−1。去离子水溶解,碳氮比为4,pH为7.0~7.5,约含100 mg·L−1的
${\rm{NH}}_4^ + $ -N和 140 mg·L−1的${\rm{NO}}_3^ - $ -N。反硝化性能测试培养基:CH3COONa 8.45 g·L−1、NH4Cl 0.63 g·L−1、KNO3 0.726 g·L−1、KH2PO4 0.18 g·L−1、MgSO4·7H2O 0.2 g·L−1、CaCl2 0.02 g·L−1、FeSO4·7H2O 0.006 g·L−1;约含160 mg·L−1的${\rm{NH}}_4^ + $ -N和100 mg·L−1的${\rm{NO}}_3^ - $ -N。去离子水溶解。将所有培养基的pH调至7.0~7.5,在121 oC灭菌30 min。 -
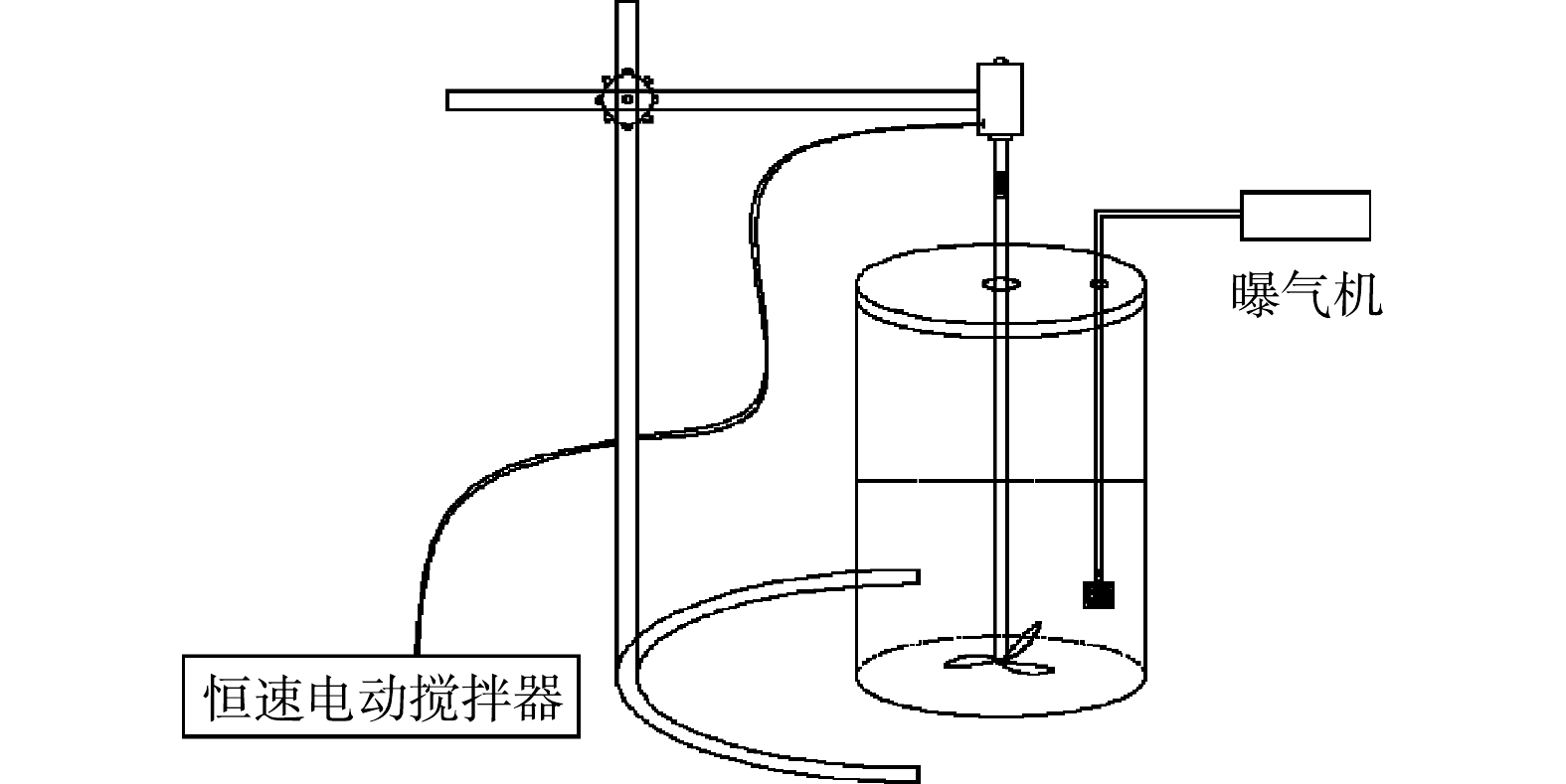
反硝化污泥的富集和驯化过程在总容积为3 L的自制透明有机玻璃SBR中进行,SBR中部配有恒速电动搅拌器,体系内部通过可调式空气泵和砂芯曝气器对反应体系进行曝气。运行周期约为24 h,包括瞬间进水、约23 h好氧反应、15 min静置沉降、0.5 h出水和闲置,排水比接近100%。取样点设置在静置前。反应装置如图1所示。
-
取400 mL反硝化污泥于SBR中,向其中加入2 L富集培养基。在转速为150 r·min−1的恒速电动搅拌下,打开曝气器进行富集培养。运行周期约为24 h(好氧反应时间约23 h)。对每个周期的出水水样进行水质分析,测定三氮(
${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N)和pH。分别取200 mL富集得到的好氧反硝化菌群样品于3个自制的SBR中,分别记为M0、M1、M2,各加入1 L驯化培养基。在每次运行周期开始前,向M1和M2反应器中分别加入250 μg·L−1 PS 和250 μg·L−1 PA,在150 r·min−1下打开曝气器进行驯化培养,运行周期与富集过程相同。对每个周期的出水水样进行水质分析比较,测定三氮(${\rm{NH}}_4^ + $ -N,${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N)、TOC、TN和pH。 -
取一定体积菌群样品,于3 500 r·min−1下离心5 min,弃去上清液,剩余样品用0.1 mol·L−1 PBS缓冲液(pH=7)重悬,将溶解氧浓度达到饱和的模拟生活污水倒入后迅速将橡皮塞塞上,体系内保证无气泡,打开溶解氧仪,每隔30 s记录溶解氧的变化值,同时测定MLSS。
-
对驯化周期结束后所取菌群样品采用超声提取法[11]进行附着型胞外聚合物(EPS)及溶解性微生物产物(SMP)的提取和测定。取4 mL菌群样品于5 500 r·min−1离心20 min,其上清液经由0.22 μm纤维素滤膜过滤,过滤液即为SMP样品,向剩余样品中加入0.9%的生理盐水至原体积后再次进行涡旋振荡,重复此操作2次。将上述样品在40 W、2 min下冰水浴超声。再将上述样品在8 000 r·min−1下离心30 min后,上清液采用0.22 μm纤维素滤膜过滤,所得溶液即为EPS样品。
-
取1 mL污泥或菌群样品,采用细菌DNA提取试剂盒 (申能博彩,上海)提取细菌的基因组DNA,最后用100 μLTAE洗脱。琼脂糖凝胶电泳检测合格后,采用高通量测序技术对提取的DNA样品进行微生物群落结构及多样性分析。
-
对提取的DNA样品进行荧光定量PCR分析,目的基因为napA、nirS、cnorB、nosZ。引物序列[12-15]如表1所示。其中16S rRNA的V3区作为内参来统一每个PCR管中cDNA总量的差异。PCR反应体系(20 μL)包括2X PCR缓冲液10 μL,10 μm的正向引物和反向引物各0.4 μL,2 μL的DNA模板,最后补充7.2 μL的ddH2O。
-
硝酸盐氮使用紫外分光光度法[16]检测;氨氮使用纳氏试剂光度法[17]检测;亚硝酸盐氮使用N-(1-萘) -乙二胺光度法[18]检测;蛋白质使用考马斯亮蓝染色法[19]检测;多糖使用苯酚-硫酸法[20]检测;pH、DO使用玻璃电极法检测;MLVSS使用重量法检测。
1.1. 菌群来源和培养基
1.2. 实验装置
1.3. 菌群的富集和驯化
1.4. 比耗氧速率分析
1.5. 胞外聚合物及溶解性微生物产物分析
1.6. 群落结构分析
1.7. 反转录-荧光实时定量PCR分析
1.8. 分析方法
-
富集实验中
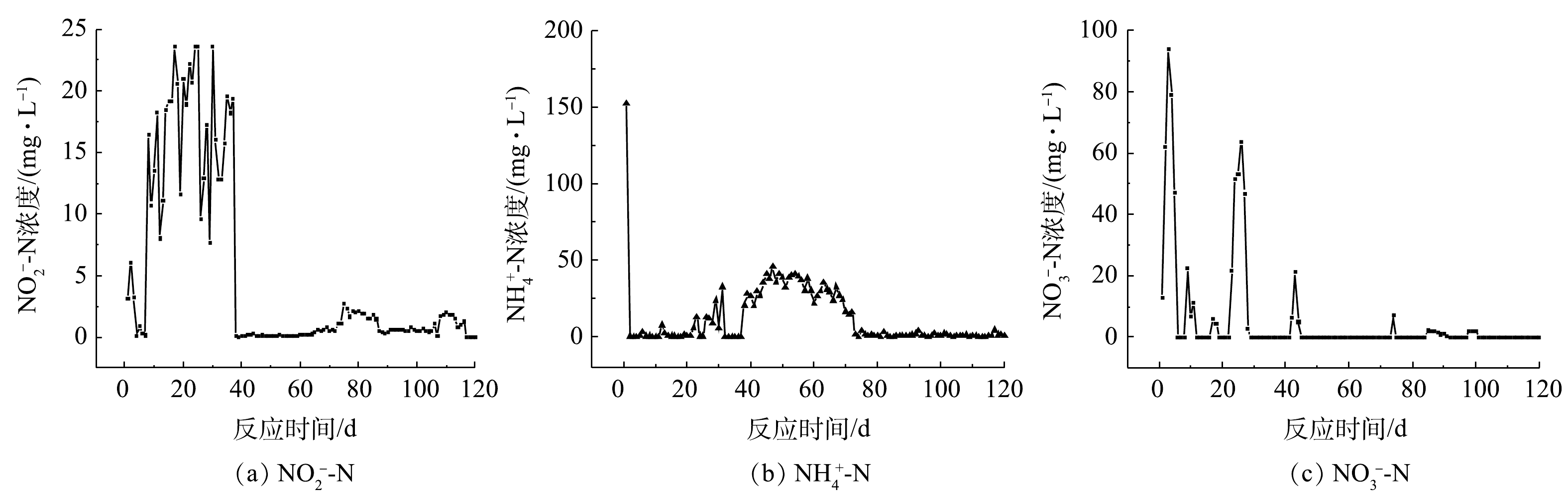
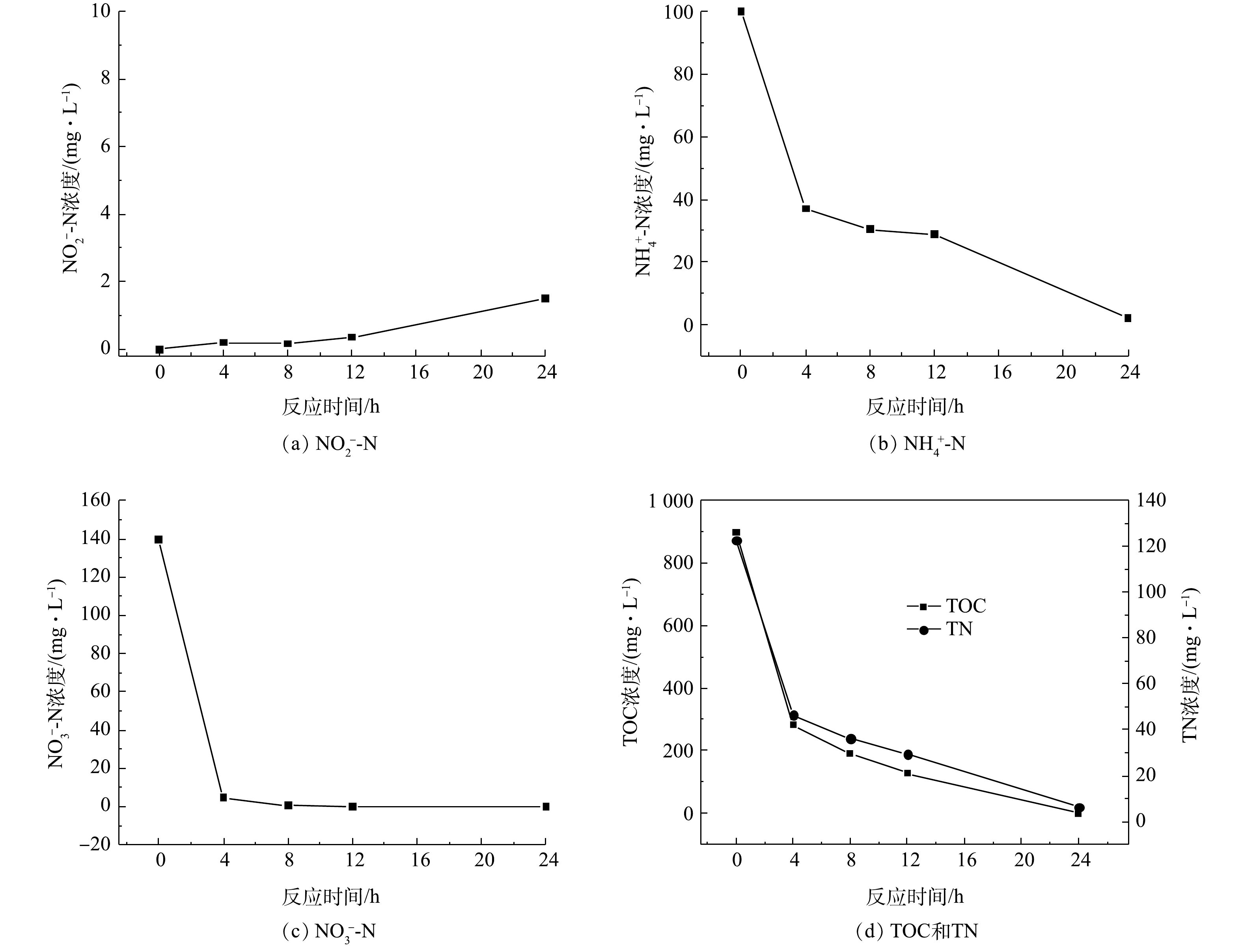
${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N的浓度变化情况如图2所示。由图2可见,接种污泥在富集之前基本无法去除模拟工业废水中的氨盐和硝酸盐,反硝化性能受到明显的抑制。经过120 d的调试和富集实验,富集菌群体系中氨氮和硝氮的去除率得到了显著提高,而亚硝酸盐氮的积累几乎不存在。这可能是由于菌群的同化作用增强了对氨氮的去除率,同时好氧反硝化作用可以将硝化作用产生的氧化态氮去除。此时反应器出水基本检测不到硝态氮的存在,且能在一段时间内保持稳定,成功富集得到良好的好氧反硝化菌群,其中发挥主要反硝化作用的是好氧反硝化细菌。在富集结束后,菌群脱氮性能的结果如图3所示。由图3可知,在好氧环境下,富集菌群表现出了良好的反硝化性能,在24 h内将初始浓度约为100 mg·L−1的氨氮几乎完全去除,24 h时氨氮的去除率约为97.9%。菌群在8 h内便可将约为140 mg·L−1的硝酸盐氮完全去除,此时的硝氮去除率可达到100%。反应体系去除硝酸盐氮的过程中,伴有微量亚硝酸盐氮的积累。在菌群富集后,模拟废水中的总有机碳和总氮也表现出与硝态氮同样的下降趋势,分别降至 0 mg·L−1和6 mg·L−1,说明菌群的脱氮性能良好。
-
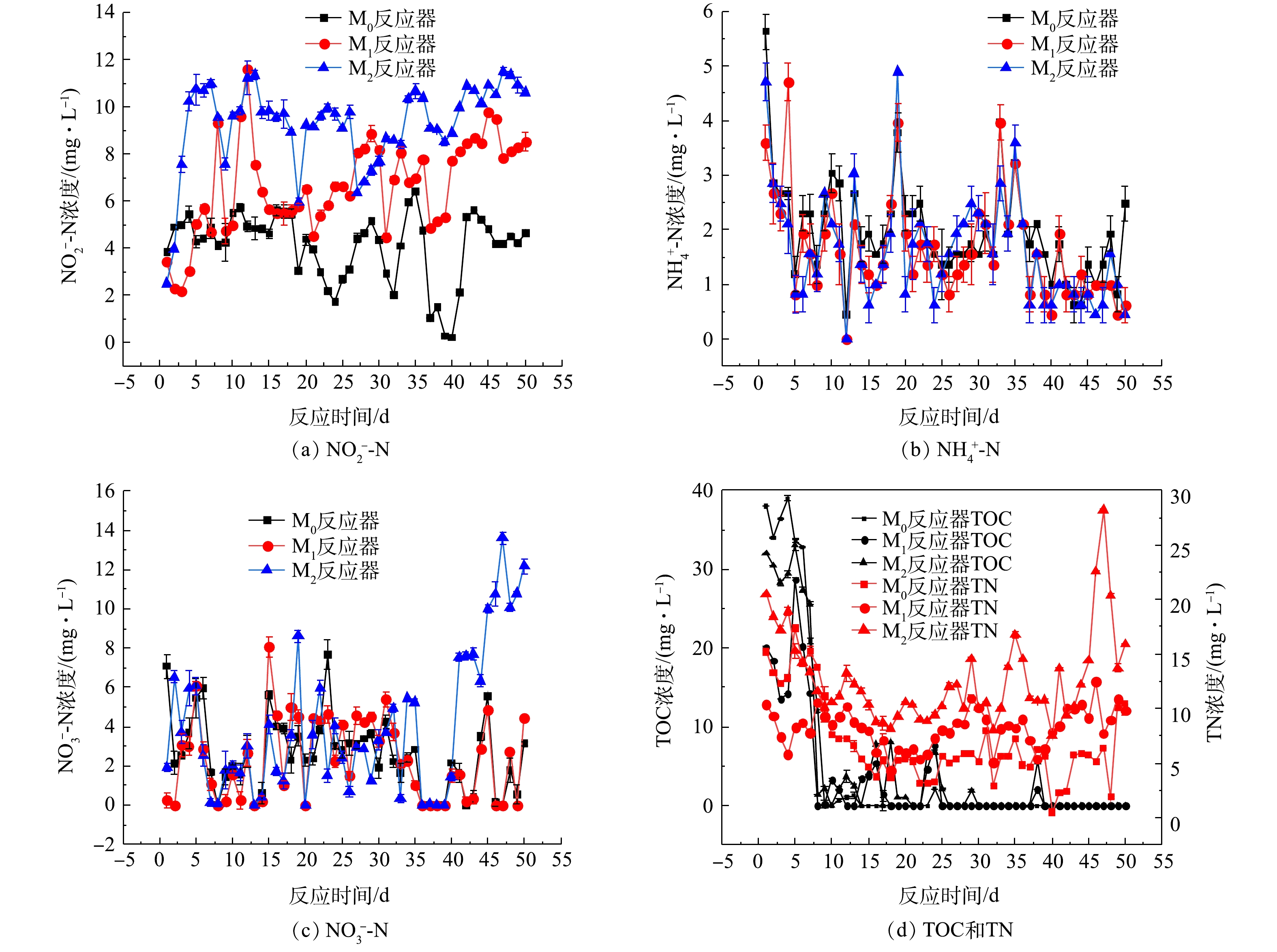
1)驯化过程中的三氮、TOC、TN变化。驯化实验中
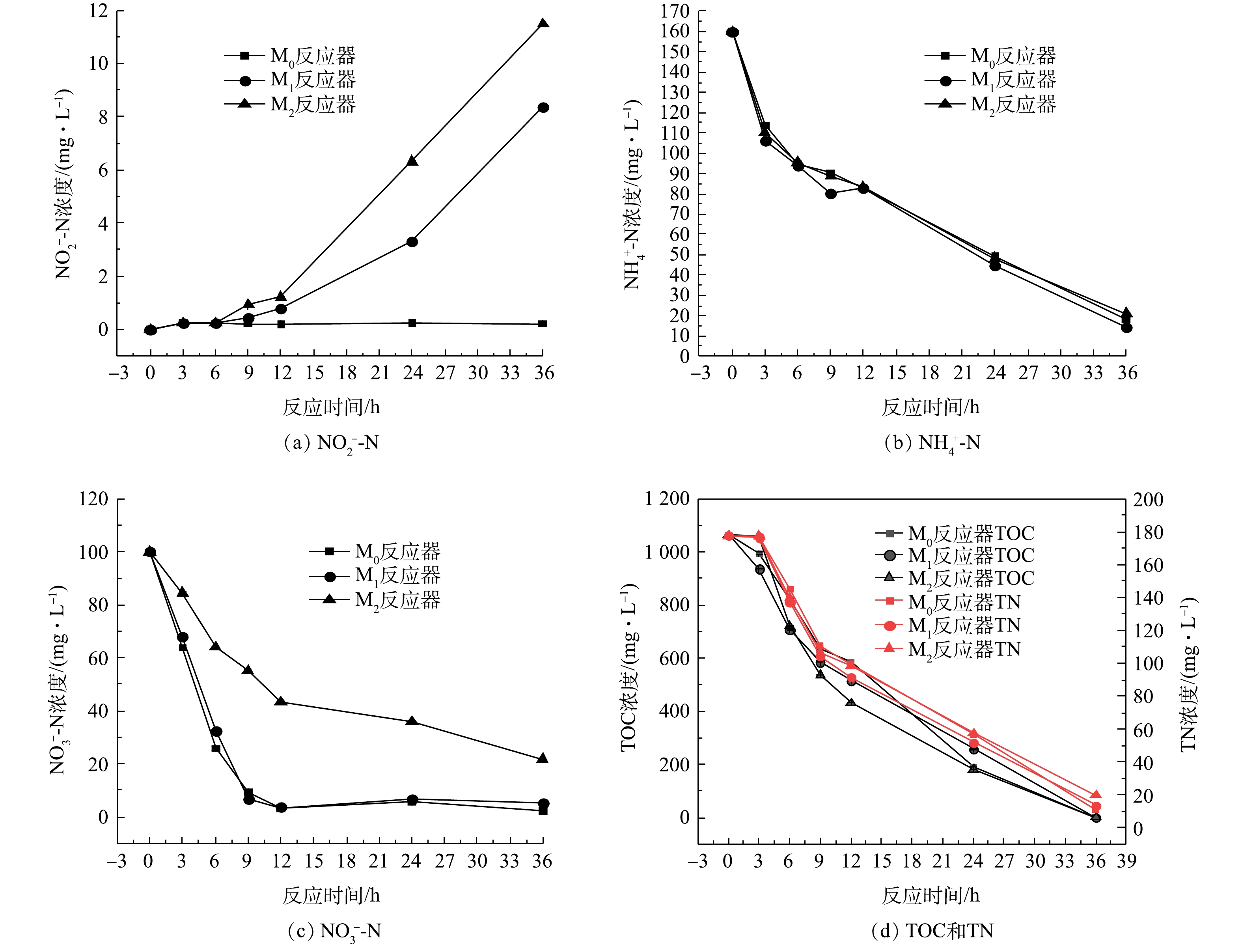
${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N、TOC、TN浓度变化情况如图4所示。由图4中可知,空白组M0的总氮、硝酸态氮的去除率均比添加了微塑料的M1和M2的高,PS与PA对于菌群的胁迫基本不会对反应体系中氨氮的去除造成影响,好氧反硝化菌群均可在驯化周期内将100 mg·L−1的${\rm{NH}}_4^ + $ -N完全去除。2种微塑料对于菌群体系去除硝态氮的影响有所不同,添加PS的M1对于硝态氮的去除不会产生抑制作用,而添加PA的M2在驯化前期与M0和M1去除${\rm{NO}}_3^ - $ -N的变化趋势相同,可以将140 mg·L−1的硝态氮完全去除;但在驯化后期,PA的累积抑制了M2中硝态氮的去除。2种微塑料均会对亚硝酸盐氮的积累产生一定的促进作用,添加PS、PA较空白组会产生不同程度亚硝酸盐氮的积累,PA的促进效果更加明显。反应过程中产生亚硝酸盐氮的积累,这可能是因为相对于硝酸盐氮还原酶,亚硝酸盐氮还原酶受氧气的抑制程度更高,这导致在相同好氧条件下亚硝酸盐氮去除速率小于硝酸盐氮去除速率,从而导致反硝化过程中存在亚硝酸盐氮积累[21-23]。由图4可知,微塑料PA的累积基本上对于总有机碳的去除不会产生影响,但会对总氮的去除产生抑制作用,与其影响硝酸盐氮的趋势相同;PS的投加对于反应体系去除总氮影响并不明显,但添加PA会导致总氮的去除率降低,约为空白组总氮去除率的50%。以上结果也进一步证明了微塑料的累积会对好氧反硝化菌群的脱氮性能产生抑制作用。2)微塑料对驯化后菌群脱氮性能的影响。取驯化后菌群测试其反硝化性能结果见图5。结果表明,微塑料PS、PA均会对驯化后菌群的好氧反硝化性能产生一定影响。第0~9小时,氨氮、硝氮和总氮的浓度下降趋势很明显,总有机碳也表现出了相同的下降趋势,期间几乎没有亚硝酸盐氮的积累,表明发生了好氧反硝化过程。与空白组相比,反应进行到12 h后,污染物PS、PA明显造成了反应体系中亚硝酸盐氮的积累,而不投加微塑料的空白组没有亚硝酸盐氮的积累,反应进行到36 h时,添加PS和PA后分别导致反应体系中亚硝酸盐氮的浓度上升至8.4 mg·L−1和11.5 mg·L−1。由图5可以看出,微塑料的长期胁迫对于好氧反硝化菌群去除氨氮和总有机碳的影响不大,几乎可以忽略不计。PS、PA影响驯化后的菌群去除硝酸盐氮的效果有所不同。与空白组硝氮去除率(97.9 %)相比,驯化后的菌群在PS累积的作用下,12 h可快速去除100 mg·L−1的
${\rm{NO}}_3^ - $ -N,硝氮去除率约为96.5%,而此时在PA累积的作用下,硝氮去除率仅为56.6%。同时,反应时间为36 h时,空白组总氮浓度由177.7 mg·L−1降至10.7 mg·L−1,而在PS和PA的胁迫下,TN浓度分别降至13 mg·L−1和20 mg·L−1。由此可见,PA对于好氧反硝化作用的抑制效果更加显著,含一定浓度的微塑料(尤其是PA)的工业废水对好氧反硝化细菌的生物脱氮效果有较大的负面影响。 -
驯化期SBR中污泥浓度的变化如图6所示。由图6可见,3个反应器中的污泥浓度均在50 d内呈下降的趋势,且M2反应器的下降趋势更加明显,这可能也是造成上文所述M2反应器出水水质较差的原因之一。
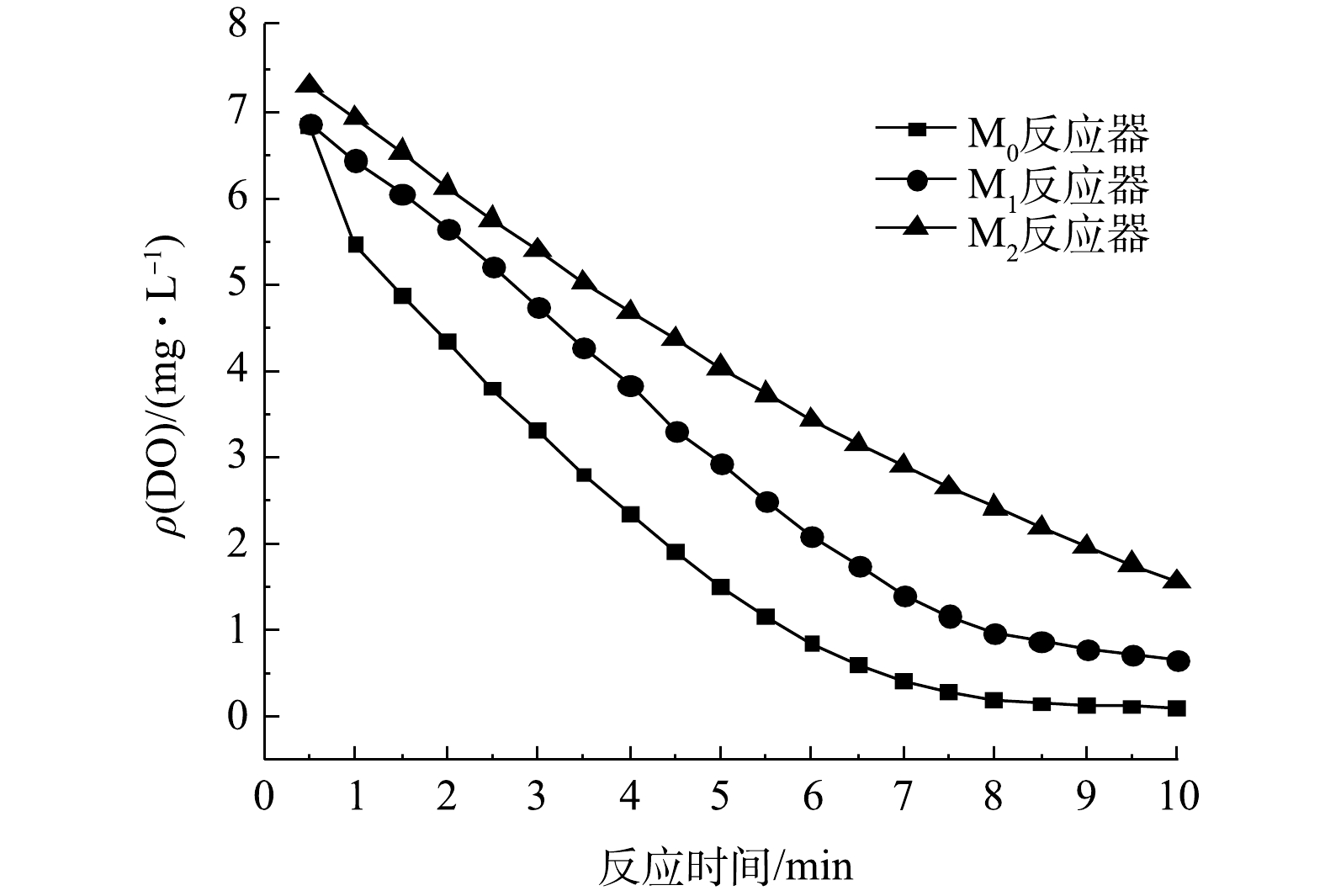
3个SBR中驯化后污泥的比耗氧速率检测结果如图7所示,由图7可知,M0、M1、M2反应器中的SOUR分别为0.209、0.203、0.306 mg·(g·min) −1。可见,添加了PA的M2的SOUR要明显高于空白实验组M0与添加了PS的M1。这说明微塑料PA的累积会使污泥的比耗氧速率得到提高,导致污泥的活性加大[24]。
-
EPS作为PN、PS等物质的复杂混合物,在促进微生物的聚集和保护中起着重要作用,还可以保护处于恶劣环境条件下的反硝化污泥[25]。有研究[26]表明,EPS的含量与污泥的稳定性呈正相关,EPS含量越高说明污泥稳定性越好。对3组SBR中驯化污泥中EPS和SMP的浓度进行监测,结果见表2。如表2所示,M1反应器EPS和SMP中的糖类和蛋白质浓度均低于M0反应器,而M2反应器EPS和SMP中浓度均高于M0反应器。由表2可以看出:从反应第10~50天,3组反应器的EPS中的糖类和蛋白质浓度均有所提高,其中M2反应器增长趋势最为显著,这可能是M2反应器出水水质较差的原因之一;3组反应器的SMP中的糖类浓度均呈现下降趋势,而蛋白质浓度则有所提高。李慧等[27]研究发现,SMP浓度增加会恶化污泥的可滤性, 从而加速膜污染。污泥的SMP含量的积累,可能会抑制污泥的代谢活性,不利于污水出水水质的改善。徐文迪等[28]研究发现,较高的EPS浓度会恶化污泥的脱水及过滤性能。由此推断,微塑料的长期积累可能会对微生物产生毒害作用,促使污泥中的微生物产生更多的EPS和SMP,导致出水水质变差,而PA对反应器的影响要大于PS。
-
采用16S rRNA高通量测序技术探索反应体系的微生物群落。Alpha多样性分析见表3。样品的覆盖指数均大于99%,说明测序深度足以覆盖样品中的大部分微生物,本次测序结果可以代表样品中微生物的真实情况。Chao1和ACE指数反映了微生物群落的丰富度,Shannon指数表征了微生物群落的多样性,值越高表示多样性越大。Simpson指数值越大,说明群落多样性越低。如表3所示,接种污泥的群落多样性最丰富,富集菌群与接种污泥相比较,Shannon值增大,Simpson值、Chao1和ACE指数减小,表明经过数天的富集过程,降低了SBR的物种丰富度,群落多样性得到了改善。添加PS、PA的Shannon指数要大于相应的空白组,而Simpson指数值低于空白组,这说明了微塑料PA和PS的累积均会造成微生物群落多样性的提高。
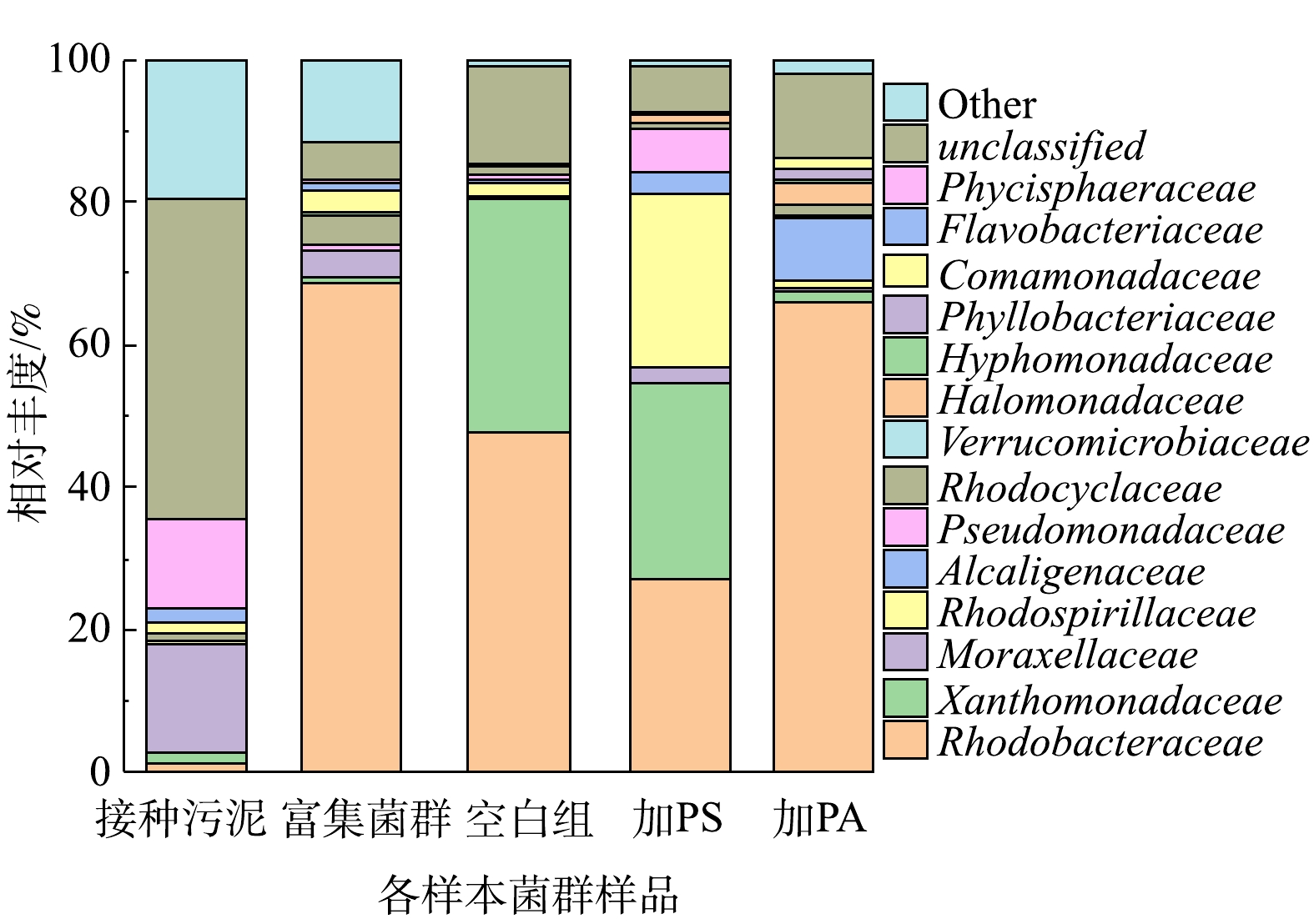
图8是各样本菌群群落在科水平上的相对丰度变化。接种污泥中优势菌种主要为莫拉氏菌科(Moraxellaceae),还检测到大量未分类的细菌序列,说明接种污泥中存在大量未鉴定的物种。经过一段时间的富集之后,莫拉氏菌科的相对丰度降至3.7%,而红杆菌科(Rhodobacteraceae)则由1.3%上升至68.7%,此时富集菌群的优势菌种主要为红杆菌科(Rhodobacteraceae)。先前的研究发现Rhodobacteraceae是一种反硝化细菌,在氮还原中发挥重要作用[29]。Rhodocyclaceae具有反硝化功能,据报道对废水中营养物的去除和好氧颗粒污泥的形成具有重要意义[30-32]。优势菌种的改变可能是造成富集前后菌群反硝化性能差异的主要原因。空白组的优势种群主要为红杆菌科(Rhodobacteraceae)和黄单胞菌科(Xanthomonadaceae),相对丰度分别为47.6%和32.9%。加PS驯化后,红杆菌科(Rhodobacteraceae)和黄单胞菌科(Xanthomonadaceae)的相对丰度分别降至27.2%和27.6 %,而红螺菌科(Rhodospirillaceae)则上升至24.4%,也成为该样本菌群的优势种群。加入PA驯化后,红杆菌科(Rhodobacteraceae)表现出了优越性,相对丰度较高,为66.1%,成为该样本菌群的主要优势种群。PS、PA的胁迫在科水平上明显改变了细菌的群落结构。
-
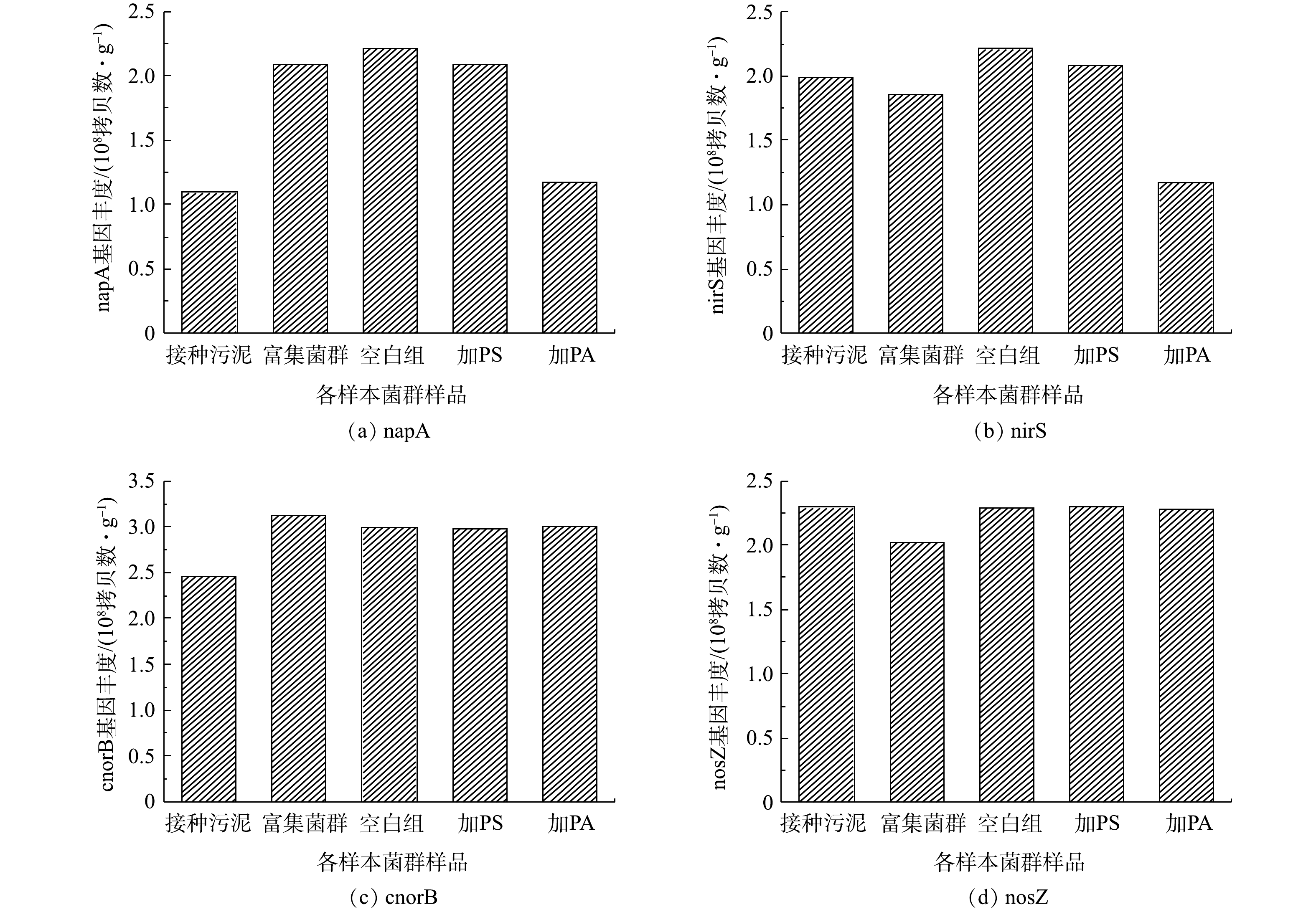
图9是各样本菌群群落基因丰度的变化。由图9可知,采用PCR技术确定了其含有napA、nirS、cnorB和nosZ等反硝化基因,且经过富集过程,napA基因的丰度得到了数量级的提高,证实了富集菌群中含有典型的好氧反硝化细菌,在好氧条件下能够由周质硝酸盐还原酶将硝酸盐还原为氮气,最终达成好氧反硝化过程,这可以解释为富集过程中微生物群落的变化促进了反硝化细菌的增殖,以往的研究也得到了类似的结果[33-35]。在目前研究的反硝化基因中,napA基因最为丰富。由图9可以看出,分别加入PS、PA 2种微塑料驯化后,napA和nirS基因出现了协同表达的趋势,2种反硝化基因的表达被抑制,其中PA的胁迫的影响程度较PS胁迫更大,导致2种基因丰度发生了数量级的降低。由此可解释加入微塑料后反应体系出现了亚硝酸盐氮的积累,同时加入PA的体系亚硝酸盐氮的积累更加明显。
2.1. 富集前后好氧反硝化性能
2.2. 菌群的驯化
2.3. 对污泥性能的影响
2.4. EPS及SMP分析
2.5. 群落结构分析
2.6. 基因丰度分析
-
1)典型微塑料PS、PA的累积均会对好氧反硝化菌群的脱氮性能产生抑制作用,产生一定量亚硝酸盐氮的积累,其中PA对于好氧反硝化作用的抑制效果更加显著。
2)微塑料PA的累积会使污泥的比耗氧速率得到提高,导致污泥的活性加大。微塑料的长期积累可能会促使污泥中的微生物产生更多的EPS、SMP,导致出水水质变差,其中PA对反应器的影响要大于PS。
3)微塑料PS和PA的长期胁迫均会造成微生物群落多样性的提高和napA和nirS基因丰度的降低。PS的胁迫会改变红杆菌科(Rhodobacteraceae)和黄单胞菌科(Xanthomonadaceae)的相对丰度,同时红螺菌科(Rhodospirillaceae)也随之成为优势种群;PA的胁迫导致红杆菌科(Rhodobacteraceae)好氧反硝化菌群中最主要的优势种群。



 下载:
下载: