-
重金属自然存在于土壤中,然而工农业生产等人为活动使其毒性水平广泛提高[1]。微量金属通过影响植物的生长、发育、开花,阻碍植物生产力,并通过食物链中的生物放大作用危害人类健康[2]。
Cd与Zn属于同族重金属元素,具有相似的地球化学和环境特性,常共存于土壤中。Cd没有生理功能,通过改变气孔运动和蒸腾作用阻碍植物生长,对植物有剧毒[3]。与Cd不同,Zn是一种必需元素,作为各种金属蛋白的辅助因子参与生理代谢[4]。然而过量的Zn也会导致生长抑制,叶片卷曲和叶尖坏死[5]。已有研究探讨了Cd、Zn胁迫作用下植物生长和重金属的吸收影响。如郭俊娒等[6]研究了不同Cd、Zn浓度胁迫作用对三七景天生长、根系形态及Cd、Zn吸收和积累的影响,研究发现三七景天具有较强的Cd富集能力;贾彦等[7]以金针菇为试验材料,研究了食用菌富集Cd、Zn以及其交互作用对食用菌累积重金属的影响;潘秀等[8]通过盆栽试验,研究了Cd、Zn及其交互作用下对互花米草生长、重金属吸收及亚细胞分布的影响。目前还没有关于Cd、Zn复合胁迫模式对长梗白菜的形态和生理性能影响研究。
与其他农作物(除水稻外[9])相比,由于绿叶蔬菜表面积大而更容易暴露在环境中受到污染[10],叶类蔬菜中积累的重金属浓度更高。长梗白菜作为普通食用蔬菜之一,与人们日常消费紧密相关。本次研究选择长梗白菜为研究对象,采用盆栽实验,通过分析生长抑制、脂质过氧化和抗氧化酶活性几个胁迫参数以及重金属吸收量,研究Cd、Zn胁迫对长梗白菜的影响。研究结果可为农田-植物系统中复合污染土壤重金属安全阈值研究和土壤重金属复合污染防治提供科学支撑。
-
供试植物为浙江农科种业有限公司的长梗白菜种子。本试验在安徽大学资源与环境学院实验大棚内进行。盆栽试验供试土壤为安徽合肥地区城郊黄棕壤土,供试土壤的基本理化性质见表1。采集表层土壤(0—20 cm),自然晾干,去除杂物,磨碎土样过2 mm筛后,玻璃罐中储存备用,而后对土壤进行人工模拟污染,取模拟重金属污染土模拟15 cm耕作层土壤厚度,种植。
-
以《土壤环境质量标准》(GB 5618—2018)农用地土壤污染风险筛选值(Cd∶ 0.3 mg·kg−1, Zn∶ 250 mg·kg−1)为参照,在塑料盆中分别设置不同重金属浓度梯度的土壤用于种植长梗白菜,将其编号。CK是空白对照组;A组是向土壤中添加不同重金属Cd浓度,分别是0.3、0.6、0.9 mg·kg−1,设置为A1、A2、A3;B组是向土壤中添加不同重金属Zn浓度,分别是150、250、350 mg·kg−1,设置为B1、B2、B3;C组是向土壤中添加不同复合重金属Cd+Zn浓度,分别为(0.3+150)、(0.6+250)、(0.9+350)mg·kg−1,设置为C1、C2、C3。
按盆栽作物对养分的需求,氮、磷、钾施用量分别为N 0.13 g·kg−1、P2O5 0.14 g·kg−1、K2O 0.3 g·kg−1。将土壤与其混和均匀,装入盆中,保持70%田间最大持水量的湿润状态,平衡1个月。分别挑选饱满、大小均一的供试种子经消毒后,用蒸馏水冲洗数次,浸泡4 h,待种子吸胀后播种,82 d成熟后采集植物和根际层土壤样品。每盆播入蔬菜种子30粒,间苗后每盆留15株。田间水分管理和肥料管理与正常的生产相一致,适时进行除草、浇水,并保持正常的日光照射。上述实验每个处理组设置3次重复实验,最后结果取3次测量的平均值。
-
将收集的蔬菜用去离子水清洗后于105 ℃烘至恒质量,后在70 ℃下将植物样品烘干,用电子天平称取干物质重量。分别称取0.2 g烘干后磨碎的根、茎、叶样品,0.5 g土壤样品。分别加入HNO3-HClO4(5∶1,体积比)和HNO3-HCl-H2O2-HF(3∶1∶1∶1,体积比)混合液于电热板上消解,消解温度开始设定为65 ℃,其次升高至160 ℃直至样品溶液澄清。利用石墨炉原子吸收分光光度计(Hitachi Z-2000,日本)测定样品中重金属含量。测定过程中以国家生物成分分析标准物质GBW10015(GSB-6菠菜)和GBW07427(GSS-13土壤)进行分析质量控制,误差控制在5%以内。
-
根据张志良等[11]的方法测定丙二醛(MDA)含量、过氧化物酶(POD)活性和过氧化氢酶(CAT)活性。此外在扫描每个分析的叶片后使用数字技术(ImageJ 1.38软件),测量植物的各个部位的长度,叶片的表面积和分形维数。
-
生物浓缩因子(BCF),转运因子(TF)和耐性指数(TI)用作评估植物积累,转运(从根到叶)和耐受重金属的能力的指数。其计算公式如下所示:
其中,Cp:植物体内重金属含量,mg·kg−1;Cs:土壤中重金属的含量,mg·kg−1;C根、C茎和C叶:根、茎和叶中的重金属浓度,mg·kg−1;T:处理过的植物生物量,g;C:对照植物生物量,g。
使用Excel软件进行数据相关计算,试验结果采用SPSS Statistics 19统计分析软件进行方差分析,不同处理间采用最小显著差数法(LSD法)进行差异显著性检验(P<0.05),采用Origin 2018软件进行作图。
-
植物生物量反映金属对其生长的影响,是植物总体健康状况的重要指标。Cd、Zn单一胁迫及其复合作用对长梗白菜各组织生物量的影响如表2所示。低浓度重金属胁迫增加长梗白菜地上部分的生物量,而高浓度抑制了其地上部分的生物量,Cd、Zn复合作用较单一胁迫的作用更显著。在0.6 mg·kg−1 Cd和250 mg·kg−1 Zn同时胁迫下叶、茎生物量分别增加93.27%和155.84%,达到显著水平(P<0.05)。在0.9 mg·kg−1 Cd及350 mg·kg−1 Zn同时胁迫下叶、茎生物量分别降低63%和66.23%(P<0.05)。这说明Cd、Zn对长梗白菜生长的影响表现出协同作用。
Cd胁迫对植物生长具有“低促高抑”的作用,这与郭俊娒等[6]的研究结果一致。在低Cd处理中,金属离子可能已经激活了细胞因子在新陈代谢中的酶,从而加速植物的生长[12]。然而,由于Cd对植物的生长不是必需的,Cd的浓度超过一定水平则具有渐进的毒性作用。与之类似,低浓度Zn单一胁迫下,长梗白菜各组织生物量干重显著提高;而高浓度下产生抑制作用。可能是因为Zn作为植物必需的微量营养元素,低浓度时参与代谢活动,而过量的Zn通过干扰必需离子的吸收,运输和调节造成离子稳态系统的紊乱,从而影响蒸腾作用和光合作用等代谢过程,导致生长减少[4]。
在Cd单一胁迫下茎生物量和根生物量具有不同的响应模式,根系生物量在0.71—0.86 g,无显著变化。Yan和Tam[13]也发现受重金属胁迫下,植物茎、叶生物量受到影响而根生物量无显著影响。Zn单一胁迫抑制长梗白菜的根系生长,在Zn浓度分别为250 mg·kg−1、350 mg·kg−1时根生物量降低40%和37.14%(P<0.05)。Cd、Zn同时胁迫在低浓度时促进,高浓度下抑制根系生长,在0.3 mg·kg−1 Cd和150 mg·kg−1 Zn同时胁迫下根生物量增加17.14%(P<0.05),在0.9 mg·kg−1 Cd和350 mg·kg−1 Zn同时胁迫下显著降低74.28%(P<0.05)。不同Cd、Zn添加量下长梗白菜耐性指数在0.35—1.98,在同时添加0.6 mg·kg−1 Cd和250 mg·kg−1 Zn时耐性指数最高。
-
植物形态特征的变化是评估重金属负面影响的重要参数。长梗白菜形态特征变化参数的值如表3所示。从表3可知,单一Cd胁迫促进了根部的长度,除0.6 mg·kg−1 Cd胁迫外其他处理对根系直径均产生了抑制作用。根系直径的降低可能是由于Cd抑制了根尖分生细胞的有丝分裂,导致染色体畸变,减少根毛生长,造成根表皮和皮层细胞以及细胞间隙的不对称,从而影响根系正常生长[14]。而张弛强[15]在研究Cd胁迫对锦葵根际特征影响时发现其根尖数在Cd(0.56 mg·kg−1)处理下出现了小幅的上升。这与本次实验中在0.6 mg·kg−1 Cd胁迫根系直径增大类似,这些现象可能是长梗白菜对Cd胁迫的一种富集和耐性机制。Cd浓度为0.9 mg·kg−1时,根直径最小,与对照处理相比下降32.48%(P<0.05)。与对照组相比,Zn单一胁迫抑制了长梗白菜的根系长度和直径。随浓度增加,根直径有所增加而根长受到抑制。在150 mg·kg−1 Zn胁迫下根直径最小,为1.6 cm;在350 mg·kg−1 Zn胁迫下根长最短,为9.68 cm。复合胁迫较Cd单一胁迫对根长的促进作用显著,在0.6 mg·kg−1 Cd、250 mg·kg−1 Zn同时胁迫下根部长度增长33.08%(P<0.05)。
与对照组相比,单一及复合重金属胁迫显著抑制了茎长,在0.9 mg·kg−1 Cd、350 mg·kg−1 Zn同时胁迫下茎长显著减少74.55%(P<0.05)。随着单一Zn或Cd浓度增加,茎长增加。这与魏明化[16]的研究结果相同,蔬菜的茎长对重金属浓度不敏感,甚至有促进作用。与对照组对比,各处理均显著降低了叶片的长度、宽度和面积。Cd浓度为0.3 mg·kg−1时,对长梗白菜叶的伤害较其他胁迫情况下严重,叶片长度减少48.35%(P<0.05),叶片宽度下降33.59%(P<0.05),叶面积下降30.55%。而表2中显示在0.3 mg·kg−1Cd胁迫下叶生物量增加,这可能是因为间苗后对照组生长出的成熟蔬菜数量偏少而0.3 mg·kg−1Cd胁迫下叶片偏小但数量多。研究结果表明,无论浓度和类型如何,重金属都会对长梗白菜形态的大多数指标产生显著影响,形态的改变更能反映Cd、Zn胁迫对植物生长的影响。
Mandelbrot等[17]提出分形结构和维数的概念。事实证明,分形维数是描述、测量和比较自然特征的有效工具,也用作植物分布的形式以及毒性指示剂[18]。从这些应用出发,本研究基于计算出长梗白菜中叶片的分形维数,分析由Cd和Zn的毒性所引起其形态的变化。将获得的有关Cd和Zn对每个实验变体的分形维数的影响的结果与对照组进行比较。图1显示叶片的分形维数。
从获得的数据中可以看出,随着Cd、Zn浓度的增加,叶片的分形维数值减小。在单一Cd污染的情况下,分形维数在浓度为0.3 mg·kg−1时为1.81,分形维数最高。在单一Zn污染的情况下,分形维数在浓度为350 mg·kg−1时为1.57,分形维数最低。Cd、Zn混合物的分形维数分别为1.79、1.78和1.58。研究数据证实与Cd相比,Zn对长梗白菜叶片具有更高的毒性作用。
-
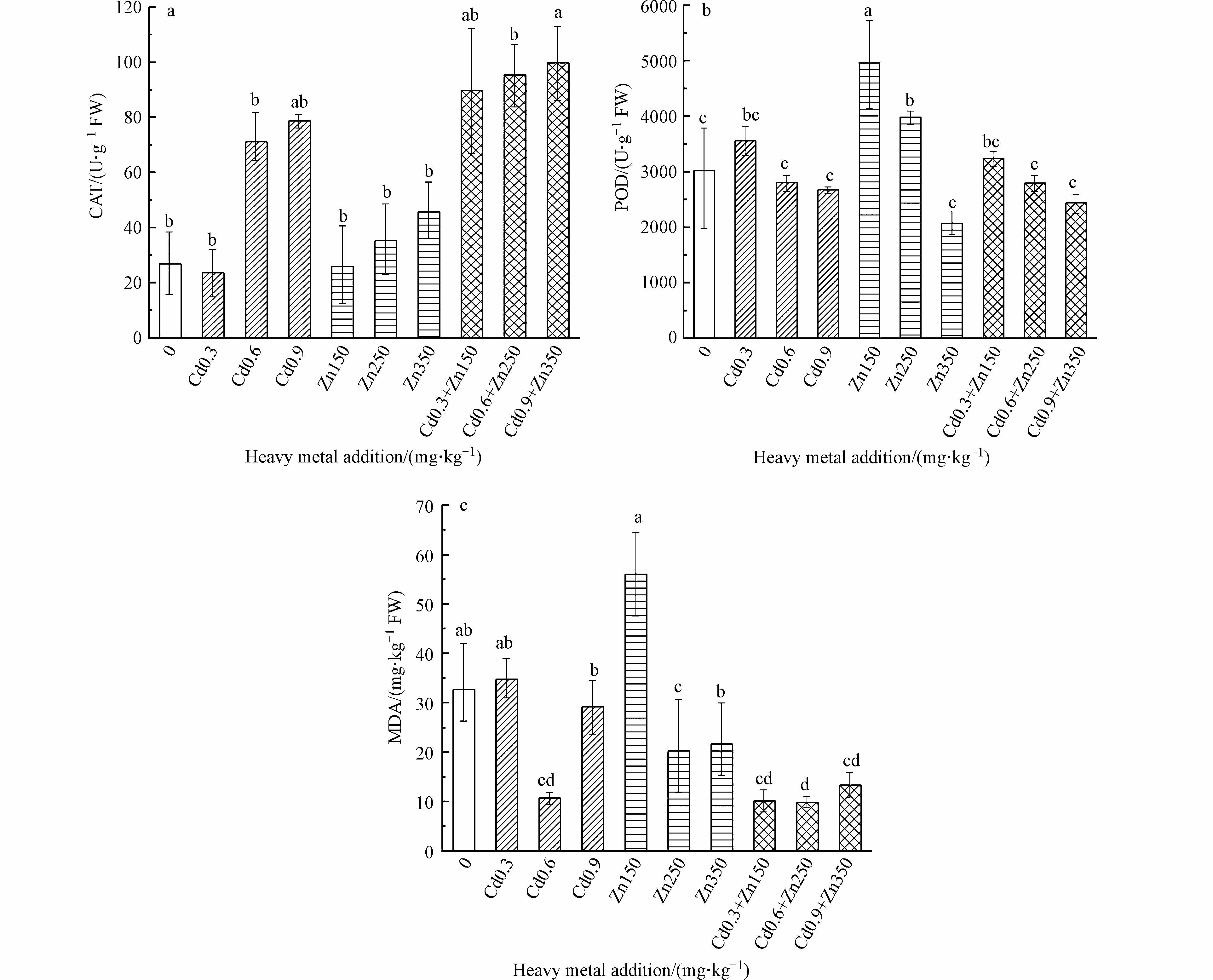
图2反映了Cd、Zn单一胁迫及其相互作用对长梗白菜抗氧化酶活性的影响。由图2(a)可知,重金属处理导致长梗白菜中CAT活性不同程度升高。在0.9 mg·kg−1 Cd和350 mg·kg−1 Zn同时胁迫下表现出最大活性99.74 U·g−1,与对照组相比增加了271.89%(P<0.05)。金属中的毒性可能是由于金属与蛋白质硫代基团的结合,抑制酶的活性或改变蛋白质的结构所致。在Zn、Cd复合处理中,–SH基团未受到Zn的硫醇氧化[19]。这可能是实验结果中重金属复合胁迫引起CAT极高诱导的原因。此外,CAT作用于过氧化氢的机理实质上是过氧化氢的岐化,必须有两个H2O2分子先后与CAT相遇且碰撞在活性中心上,才能发生反应。H2O2浓度越高,分解速度越快。Abid等[20]研究发现重金属复合胁迫导致了H2O2的升高。这也使得重金属复合胁迫下CAT活性升高。
由图2(b)可知,在150 mg·kg−1 Zn胁迫下POD表现出最大活性,与对照组相比提高了64.17%(P<0.05)。在350 mg·kg−1 Zn胁迫下POD活性最低,降低了31.50%。随重金属处理浓度的升高植物中POD活性先升高后降低,且复合重金属较单一重金属胁迫下活性降低。一方面POD活性对重金属胁迫的响应不同于CAT[21],复合重金属胁迫下产生过高浓度的H2O2造成POD的保护功能达到极限,这是由于酶活性的阈值引起的。另一方面由于复合胁迫下CAT高活性,这使其成为催化H2O2分解的主要酶,也导致了POD的活性降低[21]。POD活性与呼吸作用、光合作用及生长素的氧化等都有关系,影响植物的生长。在0.3 mg·kg−1 Cd、150 mg·kg−1 Zn复合胁迫下POD活性较高促使植物生物量增加;在0.9 mg·kg−1 Cd、350 mg·kg−1 Zn复合胁迫时POD降低抑制了植物的生长。
图2(c)反映了Cd、Zn单一胁迫及其相互作用下MDA含量的变化。由图2(c)可知,随着浓度的增加,相对于不同的重金属组合,MDA含量表现出不同的模式。单一Cd及联合处理在高浓度时均显著降低MDA含量。过量重金属对植物的主要毒性作用是氧化应激和活性氧(ROS)的过量产生[22],其特征是脂质过氧化,从而破坏了细胞膜结构。MDA是膜脂过氧化的最终分解产物[13]。而植物受重金属胁迫后,细胞组织的受损程度不仅取决于ROS产生的速率也与抗氧化系统清除其的效率有关[23]。CAT、POD可以降解掉对植物细胞有毒害作用的副产物H2O2。因此内源ROS清除剂CAT和POD活性的升高,可在长梗白菜体内清除过剩的ROS,维持ROS代谢平衡,使MDA含量降低,保护膜结构,使其具有一定的抵抗重金属胁迫的能力。在Cu处理过及Pb、Zn复合处理的欧芹[24]中也发现了类似的结果。单一Cd胁迫时,在0.6 mg·kg−1时MDA含量最低。结合图4、图5可知在0.6 mg·kg−1单一Cd胁迫POD活性开始逐渐降低而CAT却显著增加,这表明此时CAT在消除脂质过氧化中开始起主导作用,CAT的高活性使清除这些超氧自由基的效率提高从而导致MDA含量最低。在150 mg·kg−1 Zn处理下含量最大,为55.98 mg·kg−1,而在0.6 mg·kg−1 Cd和250 mg·kg−1 Zn复合胁迫下MDA含量最低,为9.81 mg·kg−1。这是因为向Cd中添加Zn可以有效抑制NADPH氧化,从而抑制O2.-产生、阻止ROS的形成[25]。
-
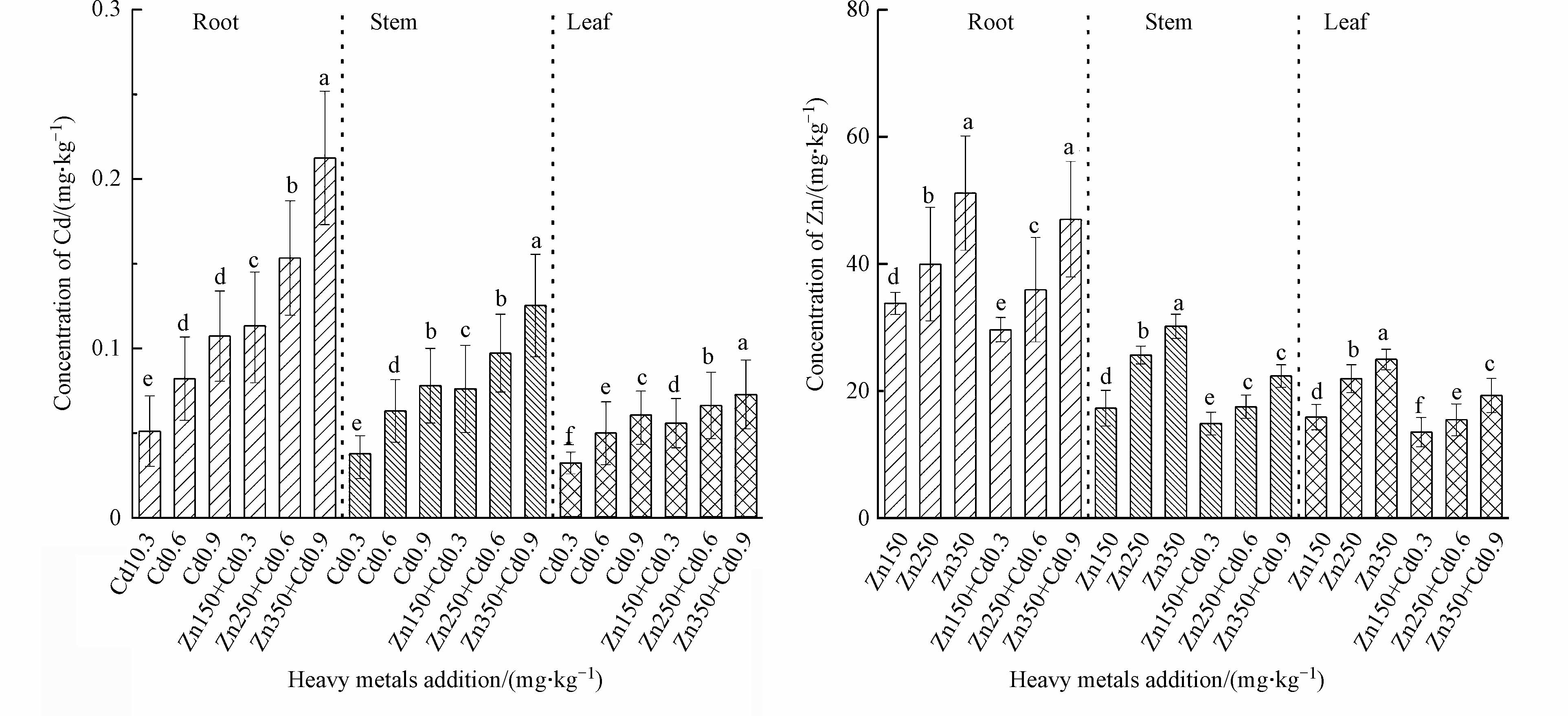
不同重金属浓度下长梗白菜的Cd、Zn富集量如图3所示。从中可知,在Cd单一胁迫下,长梗白菜各部位中Cd富集量随Cd浓度的增加而增加,且增加程度达到显著水平(P<0.05)。在Cd添加量为0.9 mg·kg−1的条件下,根的富集量最大为0.11 mg·kg−1。添加Zn使其各组织中Cd富集量增加(P<0.05),在0.9 mg·kg−1 Cd和350 mg·kg−1 Zn同时胁迫下,根中Cd含量最高,为0.21 mg·kg−1。Kutrowska等[1]研究也发现油菜在添加Zn后对Cd的吸收增加。这种反应可能与基因的上调有关,该基因的编码是由于暴露于Zn2+触发某些金属转运蛋白的传递,而通过Zn2+可以主动转运Cd2+。Cd吸收较高另一个原因是Cd和Zn对土壤吸附位点直接竞争,因两者具有相似的原子特征,都受到静电相互作用的影响[26]。考虑到所添加的Zn的浓度比Cd高,很可能是Zn导致Cd置换到溶液中,从而增加植物吸收的有效性。Zn单一胁迫下重金属富集量随胁迫浓度的增加而增加,在350mg·kg−1 Zn胁迫时,长梗白菜根中Zn的富集量最大为51.15 mg·kg−1。添加Cd使其各组织中Zn的富集量不同程度降低(P<0.05)。
在不同浓度重金属胁迫下长梗白菜中Cd、Zn的富集、转运系数结果列于表4。由表可知,复合胁迫下Cd的富集系数较单一胁迫大。这说明Zn的加入促进了Cd在长梗白菜中的富集。复合胁迫下Zn的富集系数较单独胁迫下小,说明Cd的加入抑制了Zn的富集能力,即此时Cd、Zn之间产生拮抗作用。随胁迫浓度的增加,两种重金属富集系数均呈下降趋势。这可能是因为随胁迫浓度的增加,植物对于Cd、Zn的富集量也在增加,但浓度增加速率小于土壤时,BCF随浓度增大而减小。此外植物对Cd、Zn的吸收到一定浓度范围内不再能迫使增加吸收量时。Cd、Zn复合胁迫下重金属的迁移能力较单一胁迫低,随着胁迫浓度的升高TF降低。这说明复合重金属胁迫下长梗白菜倾向在根部积累重金属而避免其吸收和转运。
-
(1)在不同的处理方法下,长梗白菜生长和生化参数发生不同的变化。Cd、Zn共同胁迫下茎叶的生物量及根长达到最高。
(2)单一Cd污染下,分形维数最高;单一Zn污染的情况下,分形维数最低。两种重金属同时作用较Zn单一污染高,添加Cd对Zn毒害叶片具有拮抗作用。
(3)重金属处理导致长梗白菜中CAT活性不同程度升高。随重金属处理浓度的升高植物中POD活性先升高后降低,且复合重金属较单一重金属胁迫下活性降低。复合重金属处理显著降低MDA含量。
(4)单一及复合污染下,长梗白菜对Cd、Zn的累积均主要发生在根部。复合作用促进其对Cd的积累,抑制对Zn的富集。复合作用均可降低对Cd、Zn的转运。
Zn和Cd胁迫作用对长梗白菜形态和生理性能的生态毒理影响
Ecotoxicological effects of Zn and Cd stress on the morphology and physiological properties of long-stalk cabbage
-
摘要: 本文以不同Cd、Zn浓度胁迫下的长梗白菜为研究对象,采用盆栽实验,分析了Cd和Zn胁迫下长梗白菜形态参数(重量、长度、表面积、叶的分形维数)、生理性能的影响以及从土壤中提取Cd和Zn的能力。结果表明,Cd、Zn胁迫对长梗白菜的生长具有“低促高抑”效应,且共同胁迫对生长的影响大于单一胁迫。在0.6 mg·kg−1 Cd和250 mg·kg−1 Zn同时胁迫下叶茎生物量分别增加93.27%和155.84%;当Cd、Zn同时胁迫下浓度分别升至0.9 mg·kg−1和350 mg·kg−1,叶茎生物量分别降低63%和66.23%。随重金属浓度的升高,植物中过氧化物酶(POD)的活性先升高后降低。与对照组相比,在150 mg·kg−1 Zn胁迫下POD活性提高了64.17%,在350 mg·kg−1 Zn胁迫下降低了31.50%。重金属处理导致长梗白菜中过氧化氢酶(CAT)活性不同程度升高。在0.9 mg·kg−1 Cd和350 mg·kg−1 Zn同时胁迫下达到最大活性99.74 U·g−1。Cd和Zn的联合处理显著降低了丙二醛(MDA)含量。Zn的添加促进Cd的吸收,根中Cd含量可达0.21 mg·kg−1。研究结果可为土壤重金属复合污染防治,提高蔬菜品质提供科学支撑。Abstract: In this paper, the long-stalk cabbage under different Cd and Zn concentration stresses was used as the research object. Potted experiments were used to analyze the morphological parameters (length, weight, surface area, leaf fractal dimension) and physiological properties of long-stemmed cabbage under Cd and Zn stress. Influence and the ability to extract Cd and Zn from the soil. The results showed that: Cd and Zn stress have a “low-promoting high-inhibition” effect on the growth of long-stemmed cabbage, and the common stress has a greater impact on the growth than a single stress. Under the simultaneous stress of 0.6 mg·kg−1 Cd and 250 mg·kg−1 Zn, the leaf and stem biomass increased by 93.27% and 155.84%, respectively; when Cd and Zn were simultaneously stressed, the concentration increased to 0.9 mg·kg−1 and 350, respectively mg·kg−1, the leaf and stem biomass decreased by 63% and 66.23%, respectively. As the concentration of heavy metals increases, the activity of peroxidase (POD) in plants first increases and then decreases. Compared with the control group, POD activity increased by 64.17% under 150 mg·kg−1 Zn stress, and decreased by 31.50% under 350 mg·kg−1 Zn stress. The treatment of heavy metals resulted in the increase of CAT activity in long-stemmed cabbage. The maximum activity of 99.74 U·g−1 was reached under the simultaneous stress of 0.9 mg·kg−1 Cd and 350 mg·kg−1 Zn. The combined treatment of Cd and Zn significantly reduced the content of malondialdehyde (MDA). The addition of Zn promotes the absorption of Cd, and the Cd content in the root can reach 0.21 mg·kg−1. The research results can provide scientific support for the prevention and control of soil heavy metal compound pollution and the improvement of vegetable quality.
-
Key words:
- Cd /
- Zn /
- oxidative stress /
- heavy metal compounding stresses /
- long-stalk cabbage
-

-
表 1 供试土壤的基本理化性质及重金属含量
Table 1. Basic physical and chemical properties and heavy metal content of the tested soil
pH 有机质/(g·kg−1)
Organic matterEC/
(ms·cm−1)黏粒/(g·kg−1)
Clay粉粒/(g·kg−1)
SiltZn/
(mg·kg−1)Cd/
(mg·kg−1)6.52 12.34±0.63 0.41±0.011 335.89±5.03 383.32±4.22 75.23±6.48 0.065±0.0019 表 2 Cd、Zn单一胁迫及其复合作用对长梗白菜生物量的影响
Table 2. Effects of single and combined stress of Cd and Zn on the biomass of long-stalk cabbage
处理组别
Treatment group叶生物量/g
Leaf biomass茎生物量/g
Stem biomass根生物量/g
Root biomassTI CK 3.27±0.04fg 1.54±0.08f 0.70±0.02e A1 4.38±0.18cd 2.55±0.12c 0.86±0.06c 1.41 A2 3.85±0.12e 1.85±0.08e 0.71±0.02e 1.16 A3 3.04±0.22f 1.36±0.04d 0.85±0.07c 1.17 B1 3.86±0.10e 2.22±0.08d 0.72±0.04e 1.23 B2 3.14±0.15fg 1.02±0.03h 0.42±0.04g 0.83 B3 3.16±0.03fg 1.23±0.14g 0.44±0.10g 0.88 C1 4.38±0.13d 2.24±0.07d 0.82±0.04cd 1.35 C2 6.32±0.23b 3.94±0.09a 0.65±0.10e 1.98 C3 1.21±0.04h 0.52±0.09i 0.18±0.02h 0.35 注∶数据为平均值±标准差,同一列不同字母代表差异显著(P<0.05).
Note∶ the data are mean ± SD, and different letters in the same column represent significant difference (P < 0.05).表 3 长梗白菜的形态参数
Table 3. Morphological parameters of long-stalk cabbage
处理组别
Treatment group根 Root 茎 Stem 叶 Leaf 长度/cm
Length直径/mm
Diameter长度/cm
Length长度/cm
Length宽度/cm
Width面积/cm2
AreaCK 10.61±3.6b 2.34±1.3abc 6.15±0.2a 14.79±3.4a 6.81±1.0a 61.05±29.1ab A1 10.64±3.2b 1.62±0.6cd 2.50±1.4bc 7.64±1.9c 4.52±1.0b 42.40±20.1b A2 11.47±3.3ab 2.78±1.5a 2.75±0.6bc 12.79±1.4ab 6.77±1.4a 68.05±22.7a A3 10.64±2.1b 1.49±0.8d 5.33±1.7abc 12.34±1.3ab 6.42±0.9a 55.48±11.8ab B1 10.38±1.7b 1.60±0.7cd 1.65±1.0c 10.84±1.2b 6.13±1.1a 44.68±12.5b B2 10.19±3.0b 1.66±0.9bcd 3.83±2.3b 10.26±4.6bc 4.41±1.7b 49.83±11.4ab B3 9.68±2.9b 1.99±1.2abcd 2.69±0.9bc 11.58±1.3b 6.05±0.6a 50.92±12.6ab C1 13.19±4.4a 1.72±0.9bcd 2.80±1.5bc 8.80±2.4bc 5.48±1.7ab 55.40±11.9ab C2 14.12±3.8a 2.15±0.7abcd 3.10±1.3bc 12.97±3.1ab 6.38±1.1a 61.54±25.0ab C3 13.43±2.4ab 2.71±1.1ab 1.57±0.8c 10.21±1.2bc 5.19±0.7ab 48.52±11.9ab 注∶数据为平均值±标准差,同一列不同字母代表差异显著(P<0.05).
Note∶ the data are mean ± SD, and different letters in the same column represent significant difference (P < 0.05).表 4 在不同浓度Cd和Zn胁迫下长梗白菜中Cd、Zn的富集、转运系数
Table 4. Enrichment and transport coefficient of Cd and Zn in long-stalk cabbage under different concentrations of Cd and Zn stress
处理组别
Treatment groupBCF TF根-茎 TF茎-叶 根 Root 茎 Stem 叶 Leaf Cd A1 0.34 0.27 0.21 0.78 0.80 A2 0.25 0.19 0.15 0.77 0.79 A3 0.22 0.16 0.12 0.73 0.77 C1 0.76 0.51 0.37 0.67 0.73 C2 0.46 0.29 0.20 0.63 0.68 C3 0.42 0.25 0.14 0.59 0.58 Zn B1 0.45 0.23 0.21 0.51 0.92 B2 0.32 0.21 0.18 0.64 0.85 B3 0.27 0.16 0.13 0.59 0.83 C1 0.39 0.20 0.18 0.50 0.91 C2 0.29 0.14 0.12 0.49 0.84 C3 0.25 0.12 0.10 0.48 0.82 -
[1] KUTROWSKA A, AGNIESZKA A, PIECHALAK A, et al. Effects of binary metal combinations on zinc, copper, cadmium and lead uptake and distribution in Brassica juncea [J]. Journal of Trace Elements in Medicine & Biology, 2017, 44: 32-39. [2] 许生辉, 南忠仁, 王胜利, 等. 绿洲土壤Cd-Ni复合污染对油菜生长及吸收的影响 [J]. 环境化学, 2018, 37(5): 1037-1044. XU S H, NAN Z R, WANG S L, et al. Effect of Cd-Ni compound pollution in oasis soil on growth and absorption of rape [J]. Environmental Chemistry, 2018, 37(5): 1037-1044(in Chinese).
[3] 杨思楠, 刘玲, 郑刘根. 多壁碳纳米管与镉复合污染对水稻生长的影响 [J]. 环境化学, 2019, 38(5): 1113-1118. YANG S N, LIU L, ZHENG L G. Effects of combined pollution of multi-walled carbon nanotubes and cadmium on rice growth [J]. Environmental Chemistry, 2019, 38(5): 1113-1118(in Chinese).
[4] SHAHZAD B, TANVEER M, CHE Z, et al. Role of 24-epibrassinolide (EBL) in mediating heavy metal and pesticide induced oxidative stress in plants: A review [J]. Ecotoxicology and Environmental Safety, 2018, 147: 935-944. doi: 10.1016/j.ecoenv.2017.09.066 [5] 朱启红, 夏红霞. 蜈蚣草对Pb、Zn复合污染的响应 [J]. 环境化学, 2012, 31(7): 1029-1035. ZHU Q H, XIA H X. Response of centipede grass to Pb and Zn compound pollution [J]. Environmental Chemistry, 2012, 31(7): 1029-1035(in Chinese).
[6] 郭俊娒, 杨俊兴, 杨军, 等. Cd、Zn交互作用对三七景天根系形态和重金属吸收积累的影响 [J]. 环境科学, 2019, 40(1): 470-479. GUO J M, YANG J X, YANG J, et al. Effect of Cd and Zn interaction on root morphology and heavy metal absorption and accumulation of sedum notoginseng [J]. Environmental Science, 2019, 40(1): 470-479(in Chinese).
[7] 贾彦, 杨勇, 江荣风, 等. Cd Zn交互作用对金针菇富集重金属的影响 [J]. 农业环境科学学报, 2009, 28(7): 1368-1373. doi: 10.3321/j.issn:1672-2043.2009.07.007 JIA Y, YANG Y, JIANG R F, et al. Effects of interactions between Cd and Zn on accumulation of heavy metals in the Flammulina velutipes [J]. Journal of Agro-Environment Science, 2009, 28(7): 1368-1373(in Chinese). doi: 10.3321/j.issn:1672-2043.2009.07.007
[8] 潘秀, 石福臣, 刘立民, 等. Cd、Zn及其交互作用对互花米草中重金属的积累、亚细胞分布及化学形态的影响 [J]. 植物研究, 2012, 32(6): 717-723. doi: 10.7525/j.issn.1673-5102.2012.06.015 PAN X, SHI F C, LIU L, et al. Effects of Cd, Zn and their interactions on accumulation, subcellular distribution and chemical forms of heavy metals in Spartina alterniflora [J]. Bulletin of Botanical Research, 2012, 32(6): 717-723(in Chinese). doi: 10.7525/j.issn.1673-5102.2012.06.015
[9] CHANEY, RUFUS L. How does contamination of rice soils with Cd and Zn cause high incidence of human Cd disease in subsistence rice farmers [J]. Current Pollution Reports, 2015, 1(1): 13-22. doi: 10.1007/s40726-015-0002-4 [10] JAISHANKAR, MONISHA T, TENZIN A, et al. Toxicity, mechanism and health effects of some heavy metals [J]. Interdisciplinary Toxicology, 2014, 7(2): 60-72. doi: 10.2478/intox-2014-0009 [11] 张志良, 瞿伟菁, 李小芳. 植物生理学实验指导[M]. (第4版) 北京: 高等教育出版社, 2009: 30-31, 98-103, 208-209. ZHANG Z L, ZHAI W Q, LI X F. Plant Physiology Experiment Guide[M]. (4th) Beijing: Higher Education Press, 2009: 30-31, 98-103, 208-209 (in Chinese).
[12] LIU Z, BAI Y, YANG T. Effect of Cd on the uptake and translocation of Pb, Cu, Zn, and Ni in Potato and wheat grown in sierozem [J]. Soil and Sediment Contamination, 2019, 22: 650-669. [13] YAN, Z Z, TAM N F. Differences in lead tolerance between seedlings of Kandelia obovata and Acanthus ilicifolius under varying treatment times [J]. Aquatic Toxicology, 2013, 126: 154-62. doi: 10.1016/j.aquatox.2012.10.011 [14] BENÁKOVÁ M, AHMADI H, DUCAIOVÁ Z, et al. Effects of Cd and Zn on physiological and anatomical properties of hydroponically grown Brassica napus plants [J]. Environmental Science and Pollution Research, 2017, 24(25): 20705-20716. doi: 10.1007/s11356-017-9697-7 [15] 张弛强. 锦葵(Malva sinensis Cavan. )在Cd胁迫下的主要根际特征和根系生理响应研究[D]. 成都: 四川农业大学, 2016. ZHANG C Q. Study on rhizosphere characteristics and root responses of Malva sinensis Cavan. under cadium stress[D]. Chengdu: Sichuan Agricultural University, 2016 (in Chinese).
[16] 魏明化. 不同土地利用方式与管理措施下土壤重金属对植物种子的生态毒性[D]. 武汉: 华中农业大学, 2012. WEI M H. Toxicity of heavy metals on plant seeds in oils with different land use and managements[D]. Wuhan: Huazhong Agricultural University, 2012 (in Chinese).
[17] MANDELBROT, BENOIT B. The fractal geometry of nature [J]. American Journal of Physics, 1983, 51(3): 286-287. doi: 10.1119/1.13295 [18] DU J X, ZHAI C M, WANG Q P. Recognition of plant leaf image based on fractal dimension features [J]. Neurocomputing, 2013, 116: 150-156. doi: 10.1016/j.neucom.2012.03.028 [19] KONLECHNER C, TUERKTAS M, LANGER I, et al. Expression of zinc and cadmium responsive genes in leaves of willow (Salix caprea L. ) genotypes with different accumulation characteristics [J]. Environmental Pollution, 2013, 178(100): 121-127. [20] ABID R, MANZOOR M, DE OLIVEIRA L M, et al. Interactive effects of As, Cd and Zn on their uptake and oxidative stress in As-hyperaccumulator Pteris vittata [J]. Environmental Pollution, 2019, 248: 756-762. doi: 10.1016/j.envpol.2019.02.054 [21] XU X Y, SHI G X, WANG J, et al. Copper-induced oxidative stress in Alternanthera philoxeroides, callus [J]. Plant Cell Tissue & Organ Culture, 2011, 106(2): 243-251. [22] WU, X Y, COBBINA, S J, MAO, G H, et al. A review of toxicity and mechanisms of individual and mixtures of heavy metals in the environment [J]. Environmental Science and Pollution Research, 2016, 23(9): 8244-8259. doi: 10.1007/s11356-016-6333-x [23] HEGED S A, ERDEI S, HORVTH G. Comparative studies of H2O2 detoxifying enzymes in green and greening barley seedlings under cadmium stress [J]. Plant Science, 2001, 160(6): 1085-1093. doi: 10.1016/S0168-9452(01)00330-2 [24] SHEN X, Li R, CHAI M, et al. Interactive effects of single, binary and trinary trace metals (lead, zinc and copper) on the physiological responses of Kandelia obovata seedlings [J]. Environmental Geochemistry and Health, 2019, 41(1): 135-148. doi: 10.1007/s10653-018-0142-8 [25] AREVALO-GARDINI E, AREVALO-HERNANDEZ C O, BALIGAR V C, et al. Heavy metal accumulation in leaves and beans of cacao (Theobroma cacao L) in major cacao growing regions in Peru [J]. Science of the Total Environment, 2017, 605-606(15): 792-800. [26] SILVA M C, ALLEONI L R F. Adsorption of Cd, Cu, Ni and Zn in tropical soils under competitive and non-competitive systems [J]. Scientia Agricola, 2010, 67(3): 301-307. doi: 10.1590/S0103-90162010000300008 -




 下载:
下载: