-
大气中的氮氧化物是产生雾霾和酸雨的主要原因之一[1]。NH3-SCR作为最有效的NOx还原方法,广泛应用于燃煤发电厂烟气净化等领域。低温等离子体 (NTP) 能够在O2存在时产生非常高浓度的活性氧,NO被活性氧O或O3氧化为NO2[2]。然而,由于等离子体中存在大量高活性物质,在转化过程中还会产生副产物N2O[3]或发生逆反应抑制NO的去除[4],反应如式(1)~(2)所示。
等离子体-催化剂协同催化已被证明是一种有效提高催化效果的手段,并且多种热催化领域的催化剂都已被证实会在与NTP结合时表现出协同作用[5]。LI等[6]研究等离子体并提高了用烃类作为还原剂的SCR性能,亦证明了等离子体通过产生醛提高了对NOx的还原能力。ZHU等[7]的研究表明NTP和Mn-Cu/ZSM5催化剂的组合显著提高了NO的去除效率。等离子体-催化剂的协同效应还体现在等离子体的应用能使催化剂的形态发生变化[8]、改变催化的反应途径[9]。进一步研究发现,催化剂的纳米特征能导致电场增强、多孔催化剂中微放电的形成及放电类型的改变[10]。近年来,由于过渡金属Mn具有多种氧化态,能在NH3-SCR过程中提供自由电子而广泛应用于快速SCR的研究[11]。CeO2具有特殊的氧化还原能力和高储氧性能,也常被作为催化剂助剂用于各种催化反应[12]。然而,目前低温等离子体作用下Ce掺杂对强化MnOx基催化剂性能机制尚未清楚。
本研究合成纳米Mn基催化剂,通过其催化氧化性、SCR活性、XRD、XPS等表征与分析等手段以探讨Ce掺杂对MnO2在等离子体中NH3-SCR的作用,以及等离子体对该型催化剂产生结构变化的影响,同时对等离子体条件下催化剂硫水耐受性进行分析,以期为NTP协同NH3-SCR去除NO的实际应用提供参考。
-
本实验催化剂采用水热沉积法制备,将KMnO4和Ce(NO3)3·6H2O按照一定物质的量比例溶解于去离子水中,将混合后的溶液密封放置在干燥箱中90 ℃反应24 h。过滤洗涤后的样品在105 ℃干燥12 h,并过筛得到40~60目催化剂。Mn和Ce的摩尔比为1/1,记作Mn-Ce,同时以相同方法制备α-MnO2。上述样品在含SO2气氛中反应后表示为MnO2-PS、Mn-Ce-PS。
XRD表征采用德国Bruker公司的D8 Advance型X射线衍射仪,Cu Kα辐射源,扫描范围为2θ=3°~80°,管电流40 mA,管电压40 kV。XPS表征采用美国Thermo ESCALAB 250Xi对催化剂表面的元素组成、含量进行测定,光源为Al Kα(1 486.6 eV)射线,能谱采用C1s的标准结合能284.5 eV进行校正,采用Avantage软件对谱图进行分峰拟合。样品形貌使用日立SU8020型扫描电子显微镜分析,扫描工作电压为15 kV。
-
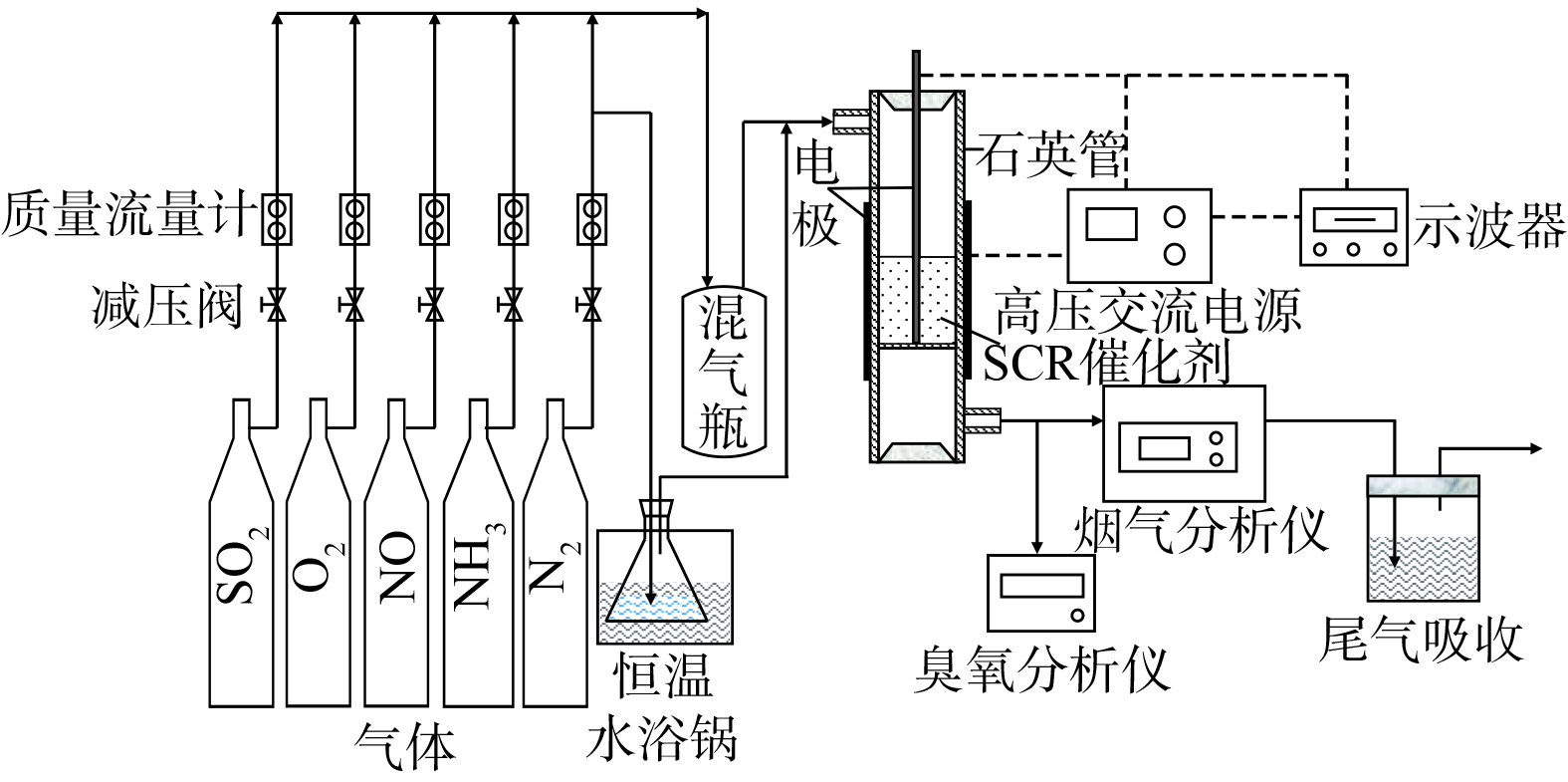
催化剂活性测试装置由配气系统、等离子体反应装置和气体分析系统组成,“一段式”介质阻挡放电协同催化还原脱硝实验流程如图1所示。NH3、NO、O2、SO2、H2O及N2平衡气模拟反应气体由质量控制器控制进入反应器。将装有去离子水的锥形瓶放在水浴锅中加热以产生水蒸气,通过氮气流与进料气体混合后通入反应器。反应在室温条件下进行,气体流量1 300 mL·min−1,其中NO进口质量浓度为535.7 mg·m−3,NH3进口质量浓度为265.6~607.1 mg·m−3,[NH3]/[NO]为1,O2为8%,SO2进口质量浓度为1 142.9 mg·m−3,N2为平衡气。进出口处气体浓度由Testo Pro.350烟气分析仪测量,O3 质量浓度由UV-1000V臭氧检测仪测得。
介质阻挡放电 (dielectric barrier discharge,DBD) 等离子体反应器由2个电极和1个石英管组成。石英管长200 mm,内径8 mm。高压电极是直径为2 mm的不锈钢棒,同轴安装在石英管内。石英管外紧密缠绕200目铜网作为负极,在等离子体反应器的放电区填充催化剂。
-
催化活性实验中,根据式 (3) 计算NOx的转化率。放电能量密度 (SIE) 是低温等离子体降解NO效果评价的重要参数之一[13],根据式 (4) 进行计算。NO、NH3氧化率分别通过式 (5) 和 (6) 计算。
式中:
${\eta}_{{\text{NO}}_{{x}}}$ -
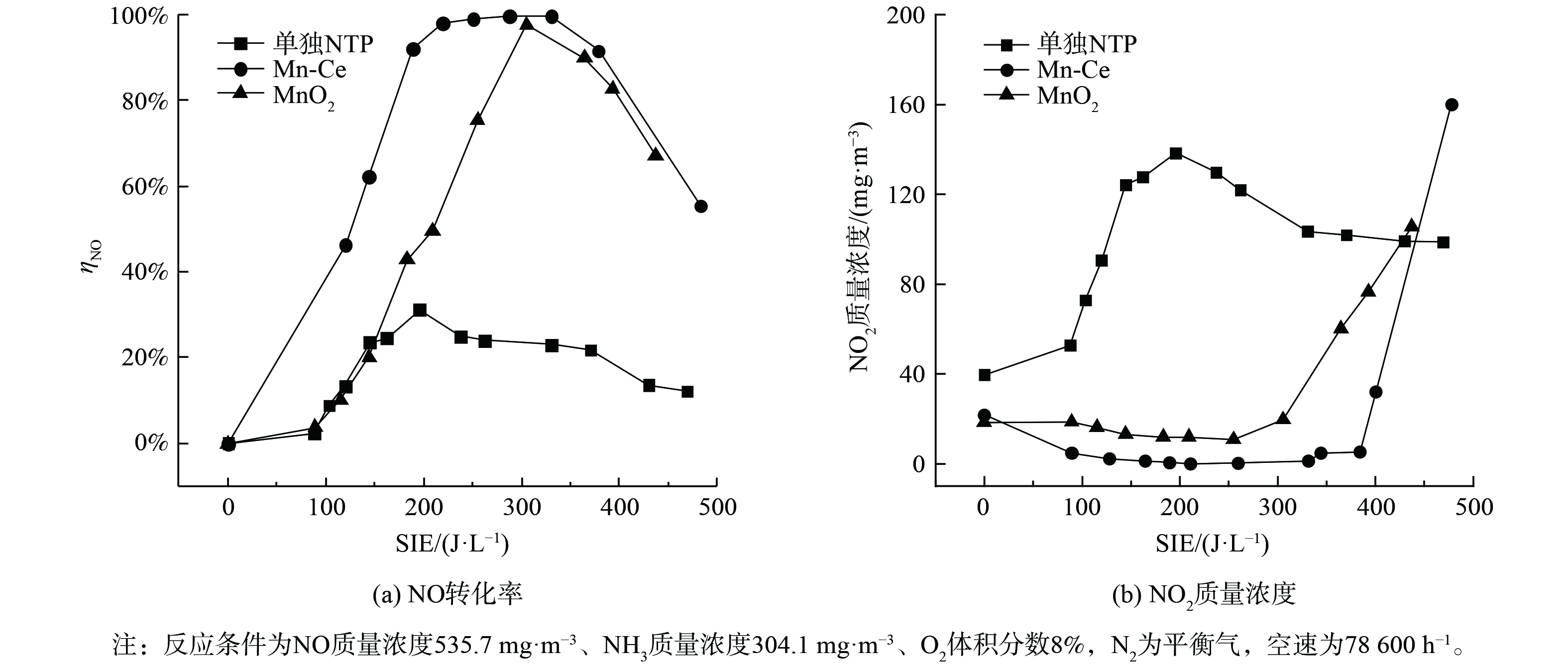
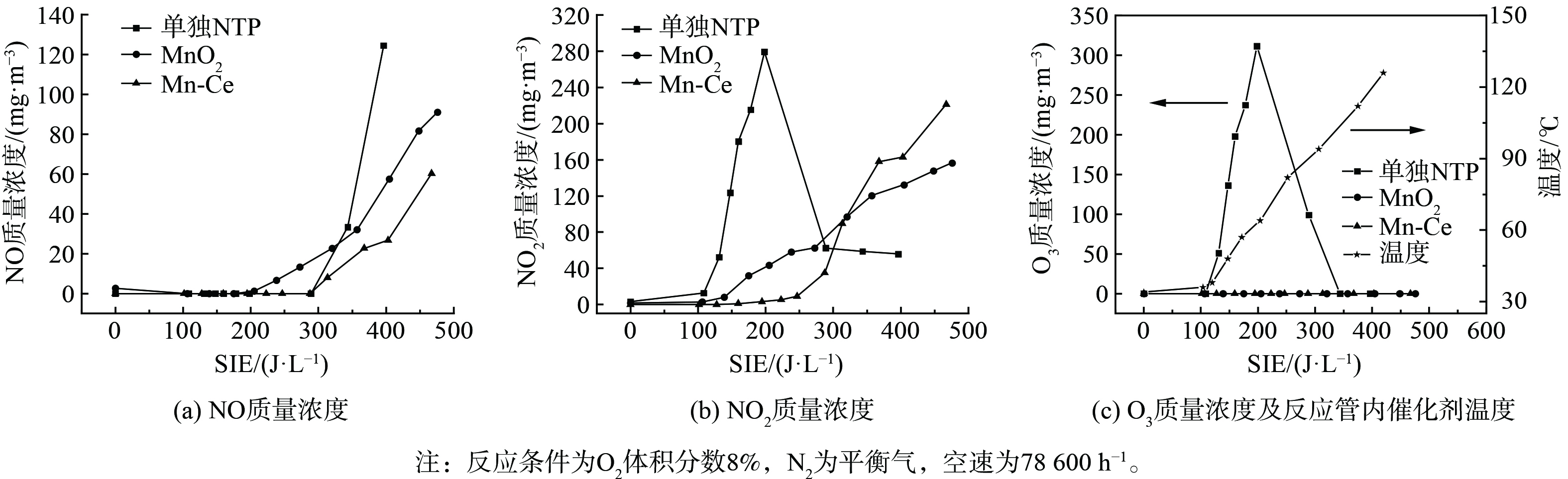
图2比较了在低温等离子条件下无催化剂、α-MnO2及Mn-Ce催化剂在NO转化率和NO2质量浓度的变化。当没有催化剂参与反应时,图2(a)显示出NO的转化率最高只有25%,仅依靠高能电子与气体组分碰撞产生的活性粒子与NO反应[13],NO转化率低。由于O2的解离能为4.81 eV,小于N2的解离能9.79 eV[14],在能量密度较小时,O2比N2更容易解离,NO主要通过O和O3生成NO2。因此,从图2(b)可发现,在SIE达到200 J·L−1之前,NO2质量浓度一直升高。其反应机理可如式(7)~(10)所示[15]。
当在反应器中加入催化剂后, NO的去除率均得到了较大幅度的提升。图2(a)表明MnO2催化剂在300 J·L−1时达到最高NO转化率97%。同时,图2(b)表明,在SIE达到280 J·L−1之前,NO2质量浓度维持在约16 mg·m−3,保持不变。这说明NO没有被大量氧化。但MnO2催化剂能量密度反应窗口较窄,SIE仅为约300 J·L−1。而图2(a)显示Mn-Ce催化剂在200~380 J·L−1下保持了90%以上的NO转化率,并且在380 J·L−1前NO2质量浓度均小于5 mg·m−3。与单纯等离子体放电相比,能量密度相对较低时,Mn-Ce催化剂使得NO2质量浓度大幅降低。这表明由NO氧化产生的NO2通过快速SCR反应参与了NO的去除。
比较图3中填充催化剂前后反应器伏安特性曲线发现,随着电压的升高,放电通道的数量和强度均增加,故放电电流也随之增加。催化剂的加入引起催化剂表面附近电场的增强,这是由于催化剂颗粒表面的局部高曲率,以及在介电材料存在引起的电荷累积和极化效应[16]。这也表明催化剂存在时放电起始电压更低,并且前期在相同电压下产生的电流更大。
-
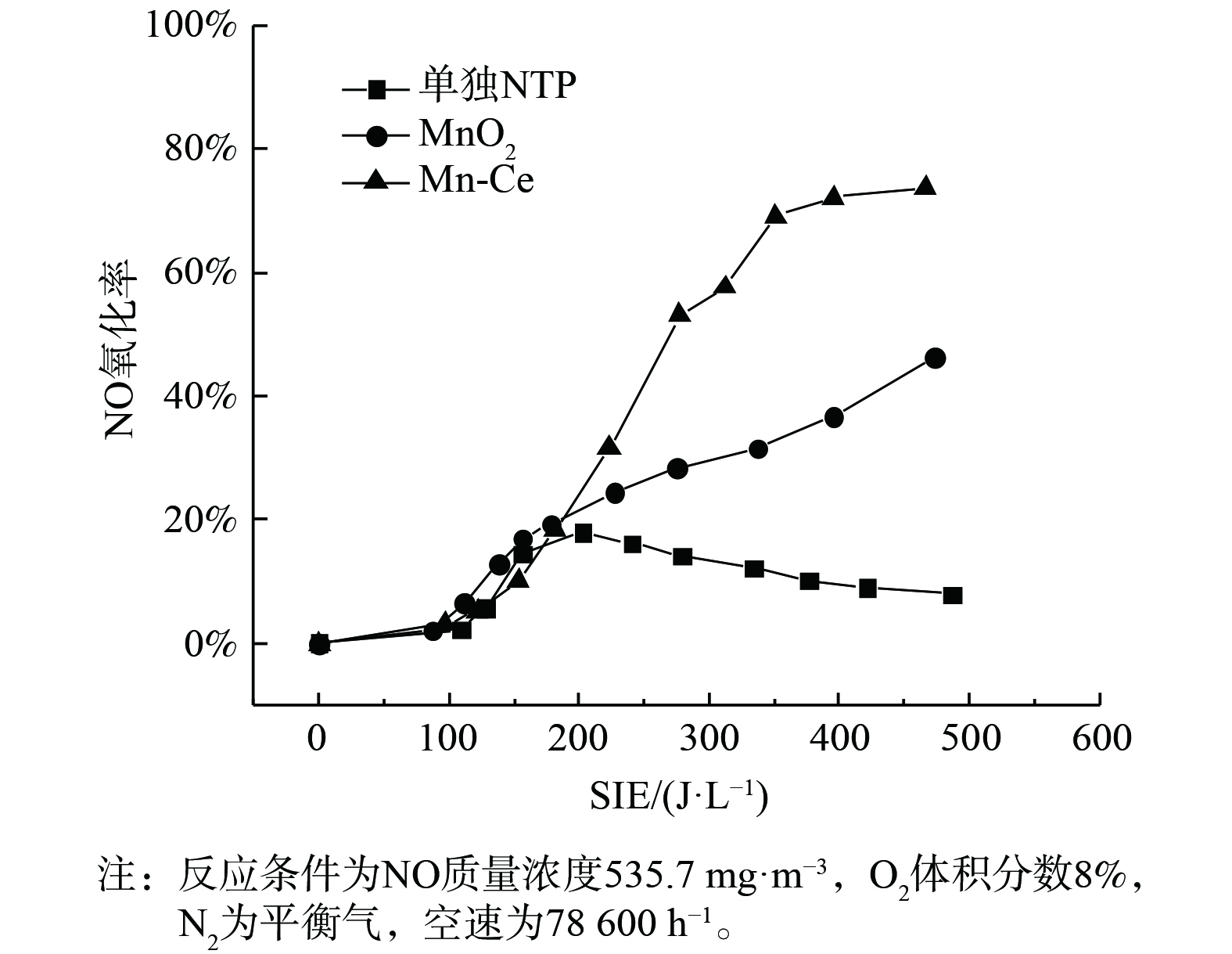
JANSSENS等[17]发现,当反应温度为200 ℃时,NH3-SCR反应可被认为是NO氧化和快速SCR反应的耦合,即发生反应2NH3+NO+NO2 → 2N2+3H2O。因此,催化剂对NO的催化氧化活性可决定其NH3-SCR反应的活性。为此,进行了等离子协同下NO氧化活性测试,结果如图4所示。
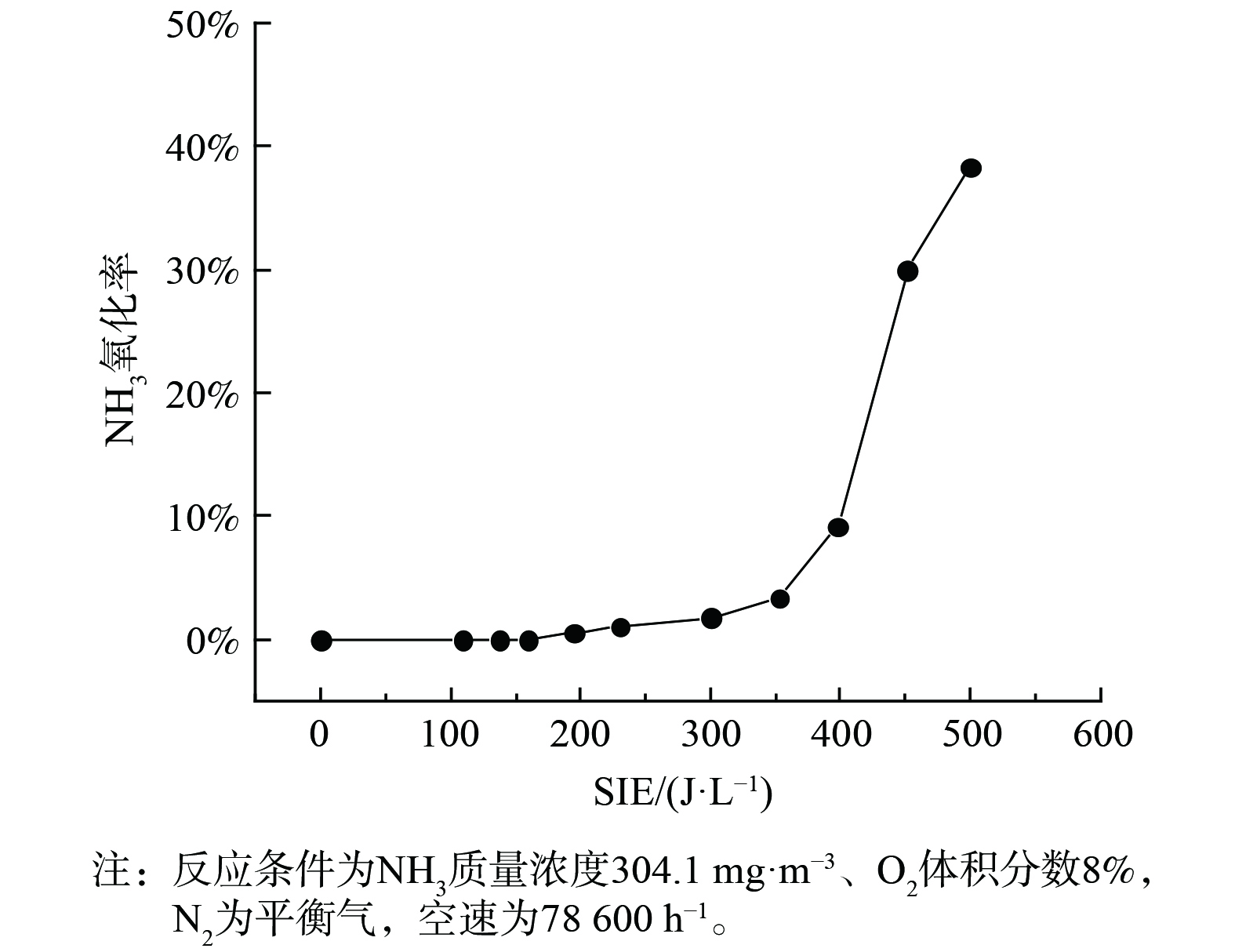
在无催化剂存在时,NO氧化率随能量密度变化关系与图2曲线变化一致。这也说明了空管反应器中NO的浓度变化主要由等离子体产生的活性粒子对NO的氧化而引起。3种条件下NO氧化活性的顺序为:Mn-Ce>MnO2>无催化剂,这与其NTP-SCR活性基本一致。2种催化剂对NO的氧化率均随能量密度的增加而上升,且Mn-Ce的NO氧化率要明显高于MnO2。这表明Ce的引入提高了Mn基催化剂的NO氧化活性,从而使其在低温下具有较高的NH3-SCR活性。同时,图2表明,能量密度大于300 J·L−1时MnO2和Mn-Ce的NO转化率开始下降,这是由于能量密度的增加使得Mn基催化剂氧化NH3生成NO,如图5所示。
-
在NTP协同催化去除NO过程中,影响催化剂性质及NO去除反应路径的主要是等离子体放电产生的O活性物种[18]。以N2/O2为气体组分,分析比较NTP放电过程中不同催化剂体系中物质变化及反应前后Mn-Ce性质的变化,进而研究NTP对催化剂的影响,结果如图6所示。在没有催化剂的条件下,随着能量密度的增加,NO2在能量密度为100~200 J·L−1时发生急剧上升,此段NO始终没有产生,并且O3含量变化趋势基本上与NO2吻合。这说明在臭氧存在时更容易形成NO2而不是NO。随能量输入的增加,反应管内温度上升臭氧开始分解,体系中NO含量开始上升。
在Mn-Ce催化体系中,NO2在能量密度159 J·L−1开始生成,此初始值高于无催化时生成NO2的初始能量密度。JIA等[19]发现,臭氧在不同晶型的Mn基催化剂表面均会发生分解,在Mn-Ce催化剂测试过程中一直没有检测到臭氧存在,这也证明了能量密度低时NO2的生成与臭氧相关。在Mn-Ce体系中,能量密度为287 J·L−1时检测到NO的存在,与无催化剂存在时NO产生的初始能量密度相近,因此臭氧对NO的产生影响较小。在能量密度为300~400 J·L−1时,3种体系中NO生成量关系为无催化剂>MnO2催化剂>Mn-Ce催化剂。Mn原子通过氧化过程将增加了电子转移到臭氧中的能力,这导致臭氧更快被分解为原子[20],促进了NO向NO2的氧化。
-
DBD放电产生等离子体会对催化剂产生影响,改变催化剂的表面性质[21]。化学吸附氧在催化还原过程中发挥了重要的作用。图7(a)显示了在N2/O2气氛中经等离子体处理前后Mn-Ce催化剂O1s区域的XPS光谱。DANIELLE等[22]发现,结合能在531 eV的O1s峰属于化学吸附氧 (Oad) ,结合能在529.5 eV的峰归属于晶格氧 (Oβ) 。与新鲜催化剂相比,等离子体处理后的Oad/Oβ从0.61下降到0.54,由于Mn-Ce催化剂的加入导致臭氧浓度减少,因此催化剂化学吸附氧含量的变化可能由催化剂分解臭氧而产生。臭氧在Mn基催化剂上的分解会使部分Mn3+可转化为Mn4+,发生反应式见式(13)和(14)。此过程导致晶格氧Oβ的增加[23]。因此,可初步得出引起Mn价态的变化是臭氧分解对催化剂的主要影响,这也与Mn的价态变化结果相对应。
催化剂上Mn2p3/2和Mn2p1/2光谱如图7(b)所示,Mn2p3/2峰经过分峰拟合后,分成Mn4+ (644.7 eV) 和Mn3+ (642.5 eV) 。比较等离子体反应前后Mn4+和Mn3+的比例发现,Mn4+的比例增加。有研究表明,Mn4+组分对NO的氧化有明显的作用[24],并且Mn4+含量的增加相应的晶格氧含量也会增加,对应XPS结果中Oβ/Oad比例的增大。
YANG等[20]发现,Ce3+ (3d104f1初始电子态) 对应位于903.7 eV和885.3 eV结合能的能带,而结合能位于907.4 eV、901.1 eV、898 eV、888 eV和882.1 eV的峰对应于Ce4+离子。Ce3+取代Ce4+时会造成晶格缺陷,有利于表面氧空位的形成,可加快活性氧的流动性。图7(c)显示等离子处理后催化剂Ce3+/(Ce4++Ce3+)比例增加了1.23%,这表明其更容易吸附氧物质和活化还原剂。
-
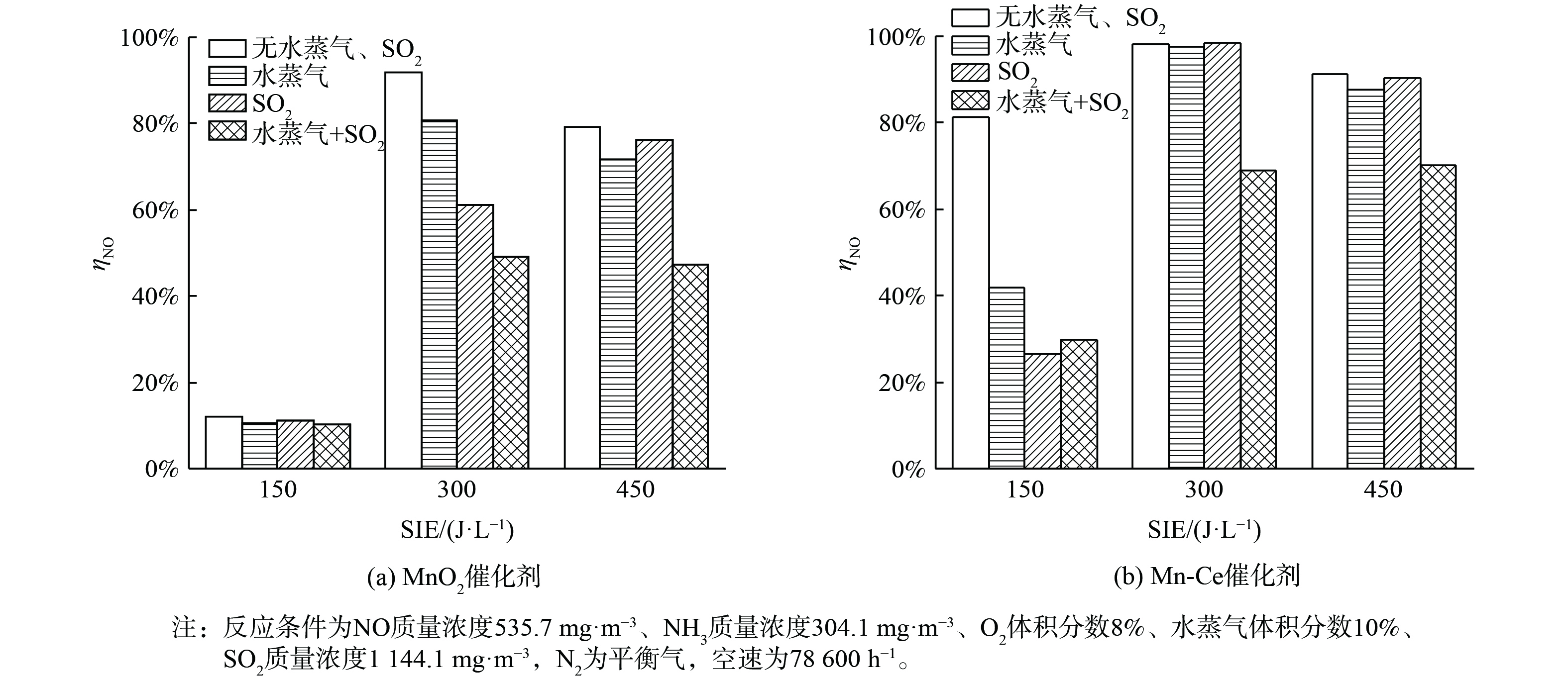
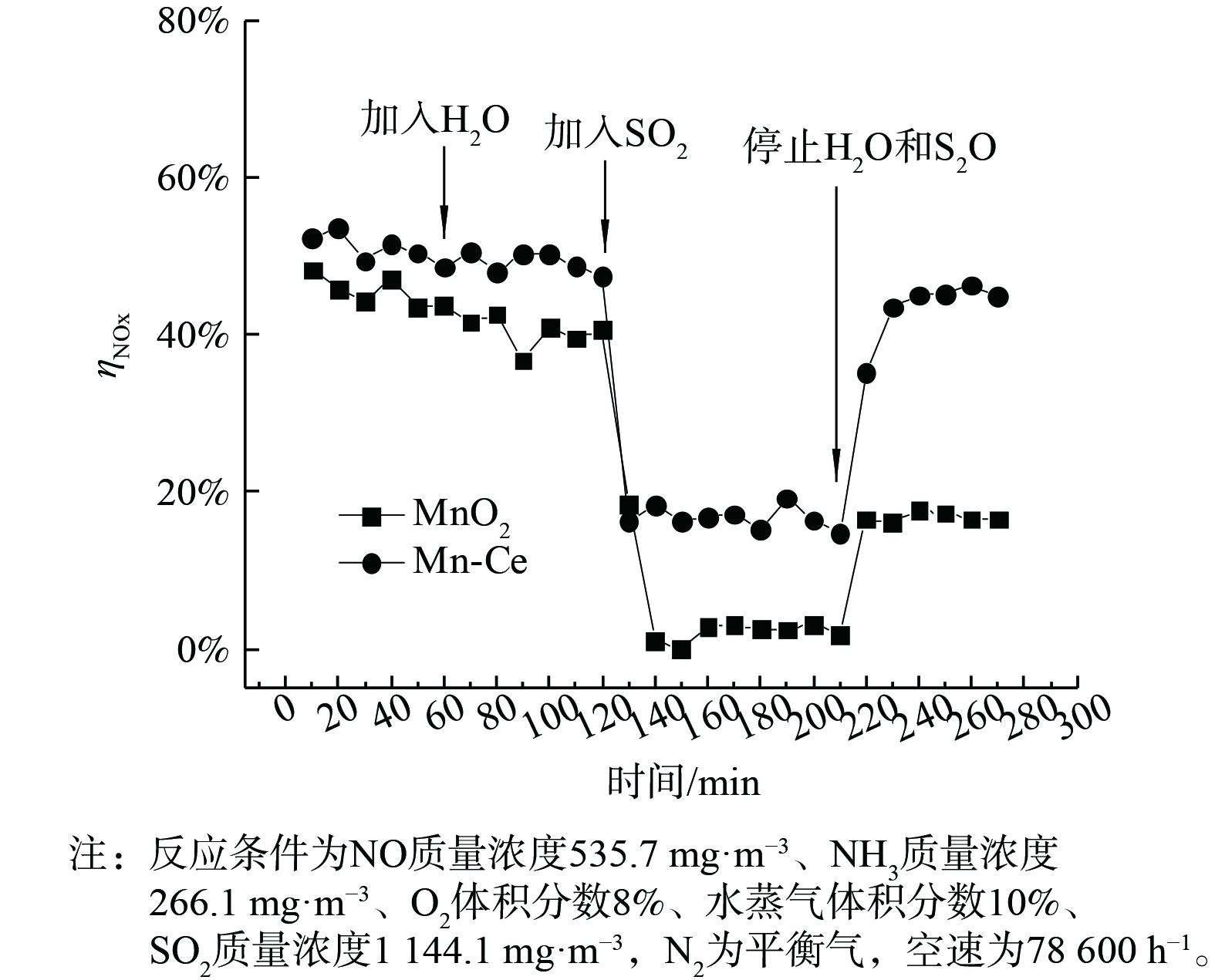
图8说明了H2O和SO2在不同能量密度下对2种催化剂的SCR活性的影响。结果表明,与单独存在H2O或SO2的情况相比,初始气体中H2O和SO2的共存更明显地导致了SCR活性的降低。当系统中存在H2O时,SO2能被O·和·OH自由基氧化,发生反应式为式 (15) 和 (16) 。氧化产物能与水反应生成H2SO4[25]。
造成催化剂失活的原因可能是还原剂NH3与SO2氧化生成的硫酸根离子在催化剂表面生成硫酸盐,覆盖催化剂活性位点并减少了参与还原NO反应的氨量。另外,催化剂的活性组分可能在SO2和H2O存在的条件下流失并硫酸化,从而导致催化剂造成不可逆失活。
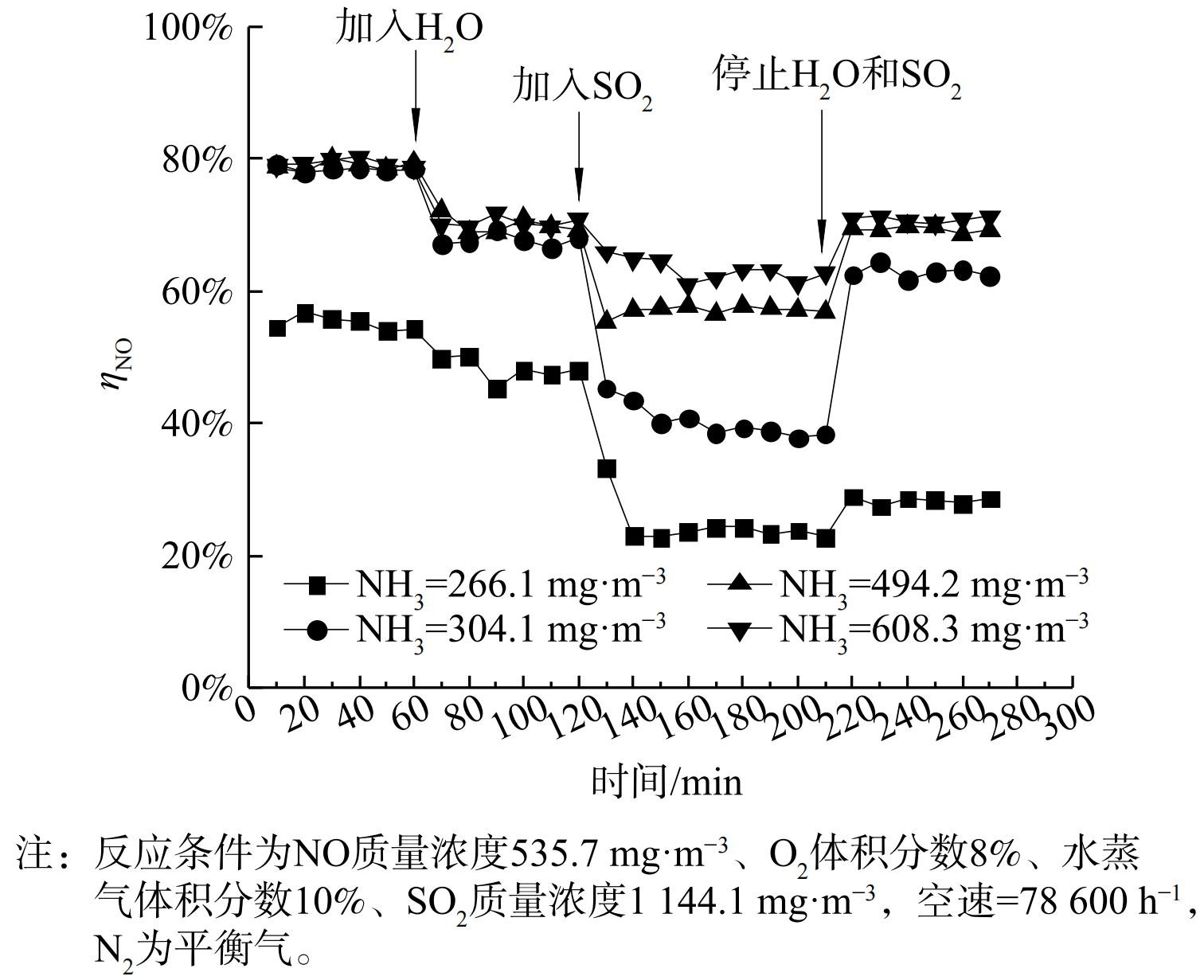
为分析等离子体条件下H2O和SO2造成催化剂失活的原因,在不同的氨气初始含量下进行SO2瞬态响应实验,能量密度为300 J·L−1,结果如图9所示。当使用MnO2催化剂时,NH3初始质量浓度的改变对催化剂脱硝活性及对H2O和SO2的耐受性显示出一定的差别。NH3量小于初始NO量时表现出最低的NO转化率,并且加入H2O和SO2后,根据NOx含量变化看出反应器中不再发生SCR反应,NO的转化全部归于等离子体对NO的氧化。当NH3/NO>1时,水蒸气对等离子催化脱硝的影响与氨含量无关。这表明通入的氨首先被SO2消耗,过剩的氨参与NO的还原。中断SO2和H2O的通入后,MnO2不能恢复到初始活性,造成了不可逆失活。ZOU等[26]发现,当烟气中同时存在NO和SO2时,SO2的吸附能力远高于NO,故SO2占据Mn的活性位点,催化剂被硫酸化。
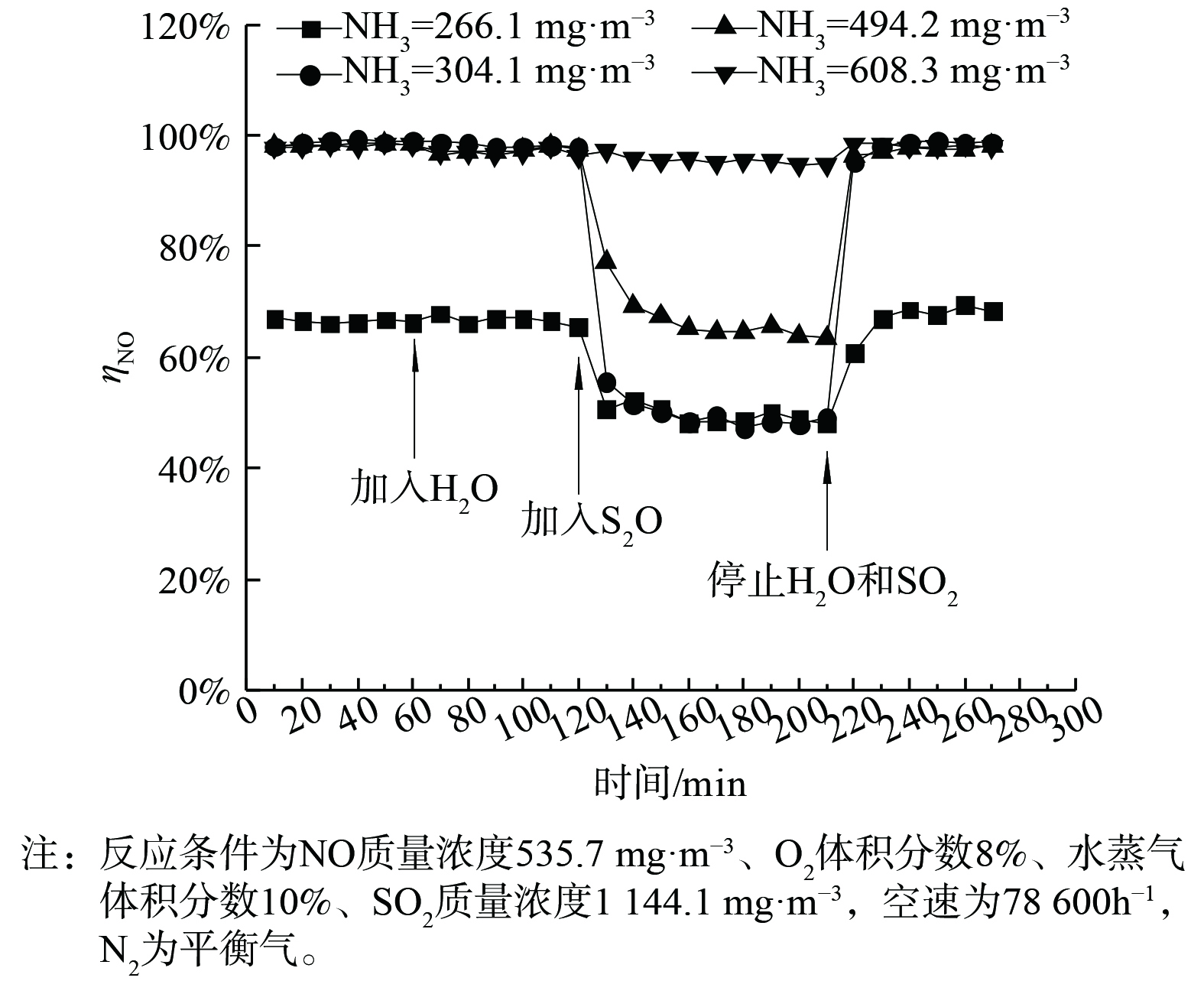
使用Mn-Ce催化剂时,与MnO2相比,在不同氨浓度下均能得到最高的NO转化率 (图10) 。水蒸气的加入对Mn-Ce催化剂转化NO只有非常微弱的影响。当NH3质量浓度为227 mg·m−3时,水蒸气和SO2的加入造成NO去除率下降,但与MnO2反应结果不同。如图11所示,Mn-Ce体系中NOx转化率并未降至0,而是维持在约18%,氨并未完全被SO2消耗。在停止通入水蒸气和SO2后,Mn-Ce催化剂的NO转化率能够恢复至初始水平。Mn-Ce催化剂与MnO2相比显示出更高的脱硝活性及耐水耐硫性。这可能是由于Ce的掺杂提高了MnOx的分散性及活性位点数量[27],并且Ce与SO2反应更敏感,因此在催化剂表面上减少了NH4HSO4和(NH4)2SO4的形成[28]。
-
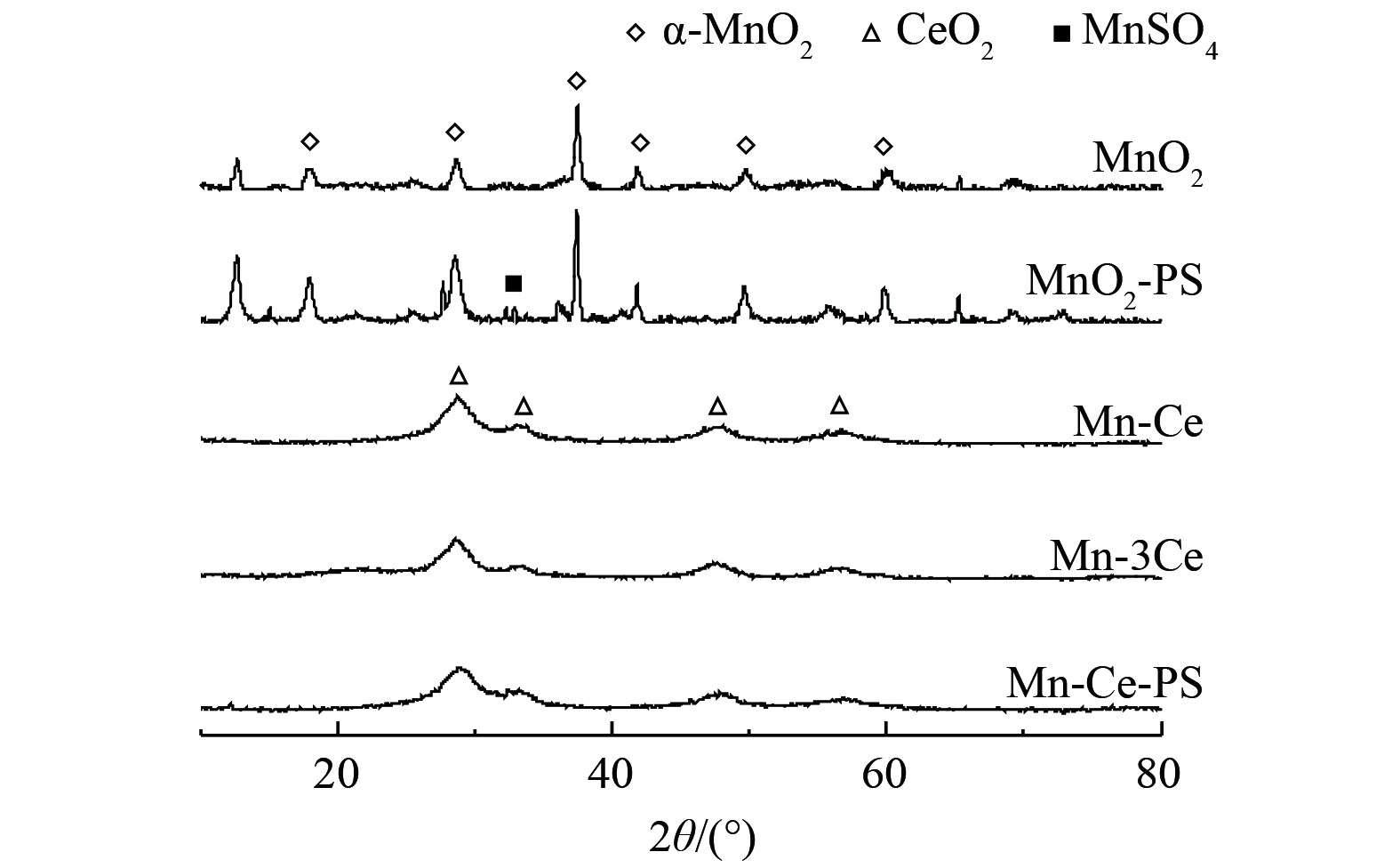
等离子体反应前后的催化剂XRD光谱如图12所示。反应前MnO2的XRD衍射峰尖锐且较窄,这说明MnO2有非常明显的结晶,对照α-MnO2的标准特征峰,所得MnO2的XRD图谱与其标准图谱完全一致,结合图13 (a) 和 (c) ,制备的MnO2为α-MnO2纳米棒。当气体组分中存在SO2放电反应后,MnO2的XRD图谱出现了新的衍射峰,已证明为MnSO4。该物质的生成引起了催化剂表面形貌的改变,并且减少了催化剂中活性组分Mn的位点数量造成催化剂活性降低。同时,对比放电前后MnO2的XRD图谱发现,经过放电使得对应的峰更加尖锐和宽泛。等离子作用后杂峰的出现表明放电对催化剂产生了负面影响。
Mn-Ce和Mn-3Ce催化剂XRD图谱表明,掺杂Ce后催化剂的衍射峰较宽。这说明2种催化剂的结晶度都不高,并且Mn-Ce催化剂中未出现MnO2特征峰。28.4°、47.4°和56.3°代表了CeO2的典型特征峰。其中,28.4°以结晶形式出现 (111) 晶面的立方体二氧化铈。对比反应前后Mn-Ce、Mn-3Ce可知,锰氧化物和铈氧化物未出现明显的新衍射峰。这表明晶格未发生变化,加入硫后附着在表面的硫酸盐以无定型态分散分布。
与MnO2相比,Mn-Ce催化剂的锰衍射峰消失。这说明MnOx以无定型形式存在,这可能是由于锰氧化物高度分散在催化剂表面、锰氧化物已进入氧化铈的晶格中所导致。结合图13 (b) 和 (d),Mn-Ce催化剂为纳米花形貌,并且拥有更丰富的孔结构。Ce掺杂后对催化剂的结晶度和结晶粒度产生了影响,削弱了等离子体和SO2对催化剂晶型结构的负面影响,从而提高了催化活性。
-
与普通的SCR反应不同,等离子体协同条件下会改变气体组分和催化剂性能。等离子体在空管部分能产生多种活性粒子,直接与NO发生碰撞[18]。在此过程中,NO大部分被转化为NO2。除了NO在高能粒子作用下被氧化为NO2之外,部分NO也能在Mn-Ce催化剂的晶格氧上氧化为NO2,并且Mn基催化剂中的Mn4+有利于NO氧化为NO2。在SCR反应中,Mn4+被还原为Mn3+,在O3和O自由基等活性物质作用下Mn3+可快速氧化为Mn4+,从而加速了NO催化氧化和快速SCR反应。快速SCR反应方程式如式 (17) 、 (18) 所示[29]。
-
1) 相比与单独等离子体放电和MnO2 ,Mn-Ce催化剂协同低温等离子体脱硝过程中拥有更高的脱硝效率和更宽的SCR反应活性区间。在室温、200~380 J·L−1条件下,Mn-Ce催化剂的NO去除率保持在90%以上。2) 在低温等离子体条件下,Mn-Ce催化剂氧化NO能力更强,会促进“快速SCR”反应发生。3) Mn-Ce催化剂能分解等离子体产生的O3,并使Mn-Ce上的Mn4+和晶格氧含量更高,更有利于NO的催化还原。4) SO2的加入会被等离子体氧化并首先消耗NH3,从而阻碍SCR反应的发生。Ce的掺杂能减少硫酸盐的生成,改变催化剂的晶型和微观形貌,增加活性位点的数量,使得耐水耐硫性得到提升。
Effect of Ce doping on the denitrification performance of MnOx in the presence of low temperature plasma
- Received Date: 08/10/2022
- Available Online: 10/05/2023
-
Key words:
- non-thermal plasma /
- NH3-SCR /
- Mn-Ce catalyst /
- synergistic catalysis
Abstract: Non-thermal plasma activates the reaction gas components, changes the catalytic reaction process, and even affects the catalyst itself, thus reflecting some excellent characteristics. Among them, the high activity of NH3 selective catalytic reduction of NOx under the cooperation of non-thermal plasma has attracted much attention. In this study, nano-Mn-Ce catalysts were synthesized by hydrothermal deposition to investigate the catalytic activities of NH3-SCR, oxidation activities of N2 and NO under the cooperation of plasma. The results showed that nano-Mn-Ce had wider SCR activity interval and better water and sulfur tolerance than nano-MnO2. The reason was that, on the one hand, the introduction of Ce could promote the dispersion of MnO2, and on the other hand, the O-active species produced by plasma could increase the content of Mn4+ and lattice oxygen in Mn-Ce, thereby triggering a stronger fast SCR reaction and promoting NOx elimination. SO2 consumed the active species generated by plasma and react with NH3, thus hindering NO conversion. However, Ce doping changed the crystal structure of Mn-based catalyst and improved sulfur resistance. This study can provide reference for the practical application of non-thermal plasma removal of NO.








 DownLoad:
DownLoad:
