-
核能作为一种安全、经济、高效的清洁能源,其特有的价值和优势正受到越来越多国家的重视。根据国际原子能机构的报告,截至2022年6月底,全球正在运行的核电反应堆共计441个,分别来自33个国家,核电总装机容量为394 GW[1]。然而,核电产业的不断发展将持续地产生放射性废水,如果不加以适当处理将会对生态环境和人类健康造成威胁。例如在2011年福岛核事故发生后,大量放射性核素泄漏到环境中,导致一些鱼类的总放射性水平至今仍保持在100 Bq·kg−1以上[2]。由此可见,放射性废水的处理对核工业的长远及可持续发展至关重要。
137Cs是放射性废水中最常见的核素之一,其半衰期约为30 a,会释放高能β粒子和γ射线。137Cs在水中通常以离子形态(Cs+)存在,具有极强迁移能力,一旦泄漏到环境中将会对生态环境及公众健康造成巨大威胁[3]。目前常用化学沉淀法[4]和膜分离法[5]对此类放射性废水进行分离处理,除此之外生物修复法[6]和吸附法等[7]也有较好的处理效果。与其他方法相比,吸附法具有成本低廉、操作简便和绿色环保等优点,目前已经成为国内外常规及应急处理放射性废水的主流方式。该方法是日本福岛核电站处理核废水的核心工艺[8]。
传统吸附剂以各种多孔材料为主,如活性炭、沸石、硅藻土等,而金属硫化物是目前对放射性废水处理效果较好的一类离子交换材料,具有较高的吸附选择性和离子交换容量[9]。有研究表明,金属硫化物对Sr2+、Cs+、UO22+等多种核素具有较好的去除效果,也能较好应用于稀土元素的回收[7,10-12]。ZHANG等[13-14]报道了一种新型纳米片状K/Zn/Sn/S金属硫化物(K/Zn/Sn/S metal sulfide nanosheet, KZTS-NS),并发现其对Sr2+、Co2+均具有良好的吸附效果。然而,截至目前该材料对Cs+的吸附潜力尚未被发掘,吸附机理也尚不清楚。
基于以上论述,本研究采用水热法合成了KZTS-NS,并对吸附Cs+前后的KZTS-NS采用扫描电子显微镜(scanning electron microscopy, SEM)、X射线衍射(X-ray diffraction, XRD)和X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)等技术进行了表征,结合定量分析进一步探究了可能的吸附机理;此外,探索了KZTS-NS对Cs+的静态吸附性能,包括动力学、热力学、等温线和环境适应性,并将其用于吸附实际水体中的Cs+。本研究结果旨在为放射性废水中Cs+的处理提供技术参考和基础数据支撑。
-
准确称取3.317 1 g碳酸钾(≥99.0%)、0.784 7 g锌粉(≥98.0%)、2.849 0 g锡粉(≥99.5%)和3.847 2 g硫粉(≥99.999%)于100 mL聚四氟乙烯内胆中并混合均匀,加入去离子水30 mL,然后将其密封于水热反应釜中,在200 ℃下反应4 d。产物用去离子水清洗数遍后,再分别用乙醇和二硫化碳清洗,并在80 ℃下真空干燥16 h。最后经研磨、过100目筛后,得到棕黄色粉末状KZTS-NS材料。
-
吸附实验操作如下:取适量的吸附剂于50 mL离心管中,加入25 mL预先配制好的Cs+溶液。将混合后的悬浊液放入恒温摇床中振荡。若无特殊说明反应温度均为25 ℃。待吸附反应结束后,从摇床中取出离心管,悬浊液用0.22 μm滤膜过滤。滤液中Cs+的质量浓度通过电感耦合等离子体发射光谱仪(ICP-OES,Avio 200,珀金埃尔默股份有限公司)和电感耦合等离子体质谱仪(ICP-MS,iCAP RQ,赛默飞世尔科技有限公司)测定。
1)吸附动力学。吸附动力学实验在250 mL的烧杯中进行,向烧杯加入200 mL Cs+溶液,并加入100 mg吸附剂,然后在磁力搅拌下进行吸附反应。Cs+溶液浓度为5 mg·L−1,设置取样时间为0~60 min。
2)吸附等温线。吸附等温线的实验条件为:C0Cs = 10、20、30、40、50、60、70、80、90、100 mg·L−1;m=12.5 mg;v=25 mL;t=16 h。其中C0Cs为Cs+溶液的初始浓度,m为吸附剂的质量,v为Cs+溶液的体积;t为反应时间。
3)吸附剂投加量的影响。吸附剂的投加量分别为:0.25、0.50、0.75和1.00 g·L−1。实验条件为:C0Cs = 5 mg·L−1;m=6.25、12.5、18.75、25 mg;v=25 mL;T=25 ℃;t=12 h。其中T为反应温度。
4)溶液pH的影响。溶液的pH通过滴加1 mol·L−1的HCl和NaOH调整。实验条件为:pH=2~12;C0Cs = 5 mg·L−1;m=12.5 mg;v=25 mL;T=25 ℃;t=6 h。
5)共存离子的影响。溶液中的共存离子分别用KCl、NaCl、CaCl2·2H2O和MgCl·6H2O配制。实验条件为:C0Cs =5 mg·L−1;m=12.5 mg;v=25 mL;T=25 ℃;t=6 h;溶液中K、Na、Ca或Mg的浓度为0.1、1、10、100 mmol·L−1。
6)实际水体中的吸附。分别选取自来水、矿泉水、湖水和海水作为实际水体,向其加入Cs+以模拟受Cs+污染的实际水体,并以加入Cs+的纯水作为对照组。其中,纯水由实验室纯水机所制;自来水取自实验室;矿泉水为市售农夫山泉品牌矿泉水;湖水取自闽江学院芙蓉广场;海水取自福建省福州市三沙湾海域。实验条件为:C0Cs = 5 mg·L−1;m=12.5 mg;v = 25 mL;T=25 ℃;t=6 h。
-
1)对Cs+的去除率和平衡吸附量分别根据式(1)和式(2)进行计算。
式中:R为去除率,%;C0和Ce分别为吸附前后溶液中Cs+的质量浓度,mg·L−1;qe为平衡吸附量;mg·g−1 m为吸附剂投加量,mg;v为溶液的体积,mL。实验设置2组平行,取2组数据的平均值以及标准差。
2)吸附动力学数据分别用拟一级动力学和拟二级动力学模型进行拟合,两者对应的计算公式分别如式(3)和式(4)所示。吸附热力学数据根据式(5)~(7)计算。吸附等温线数据分别用Langmuir(式(8))与Freundlich模型(式(9))进行拟合。
式中:t为吸附时间,min;qt为t时刻的吸附容量,mg·g−1;k1是拟一级动力学模型速率常数,min−1;k2是拟二级动力学模型的速率常数,g·mg−1·min−1。
式中:R为理想气体常数,J·(mol·K)−1,取8.314;T为绝对温度,K;Kd为分配系数,mL·g−1;ΔGθ为吉布斯自由能变,kJ·mol−1;ΔHθ 为焓变,kJ·mol−1;ΔSθ 为熵变,J·(mol·K)−1。
式中:qm为理论最大吸附容量,mg·g−1;b为Langmuir常数,L·mg−1;Kf为Freundlich常数,L1/n·mg1/n−1·g−1;n为Freundlich强度参数,无量纲。
-
分别取吸附前和吸附后(吸附条件为:C0Cs=500 mg·L−1, m=250 mg, v=500 mL, t=16 h, 25 ℃)的KZTS-NS样品,用于表征测试。通过SEM(Hitachi S-4800,日本日立株式会社)观察吸附材料的形貌,并通过能谱仪(EDS,Hitachi S-4800,日本日立株式会社)测定吸附剂上元素的含量及分布;通过XRD(D8 Advance,德国布鲁克科技有限公司)对吸附材料的组成与结构进行分析;利用XPS(ESCALAB 250Xi,美国赛默飞世尔科技有限公司)分析材料的元素组成和价态。
-
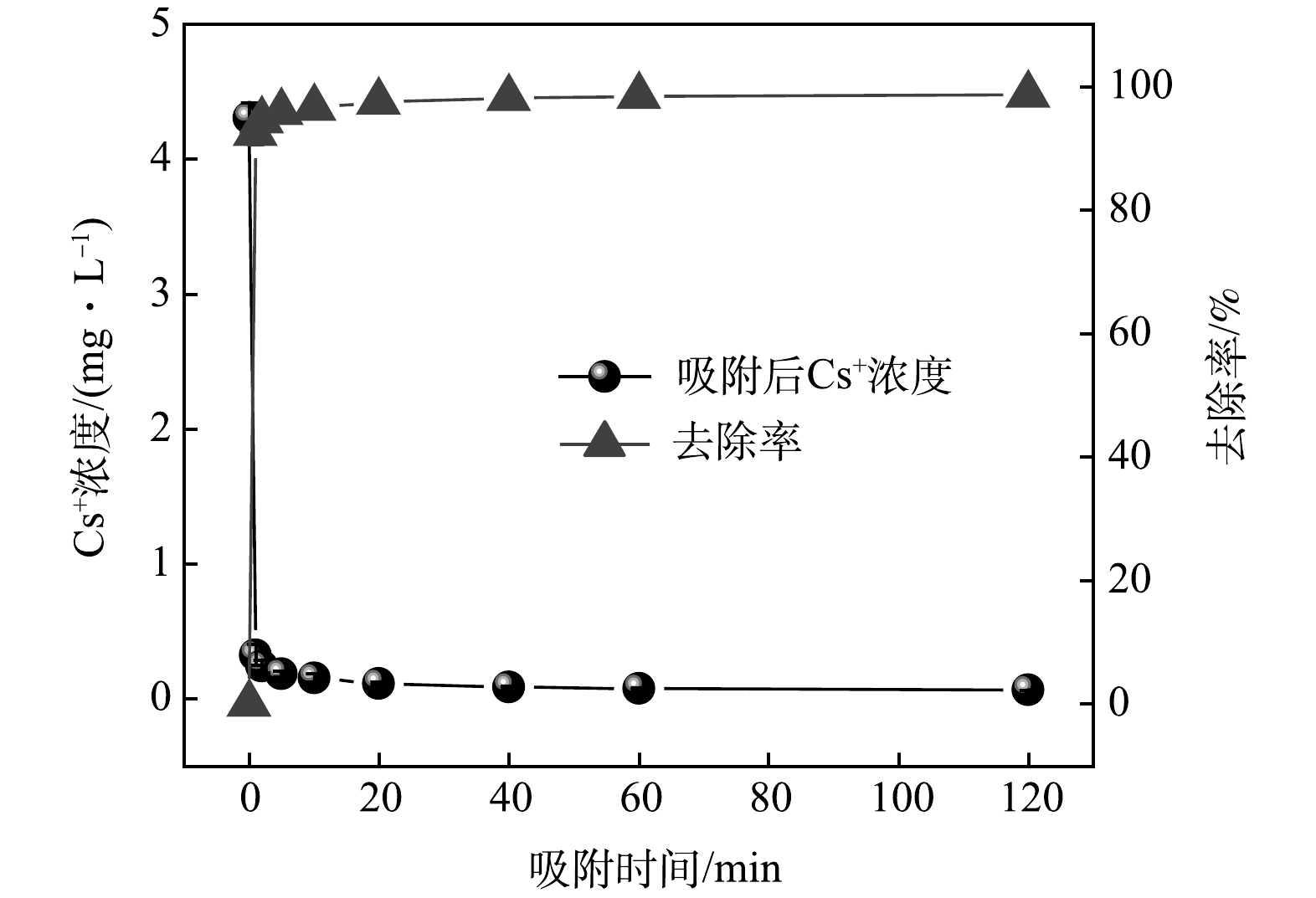
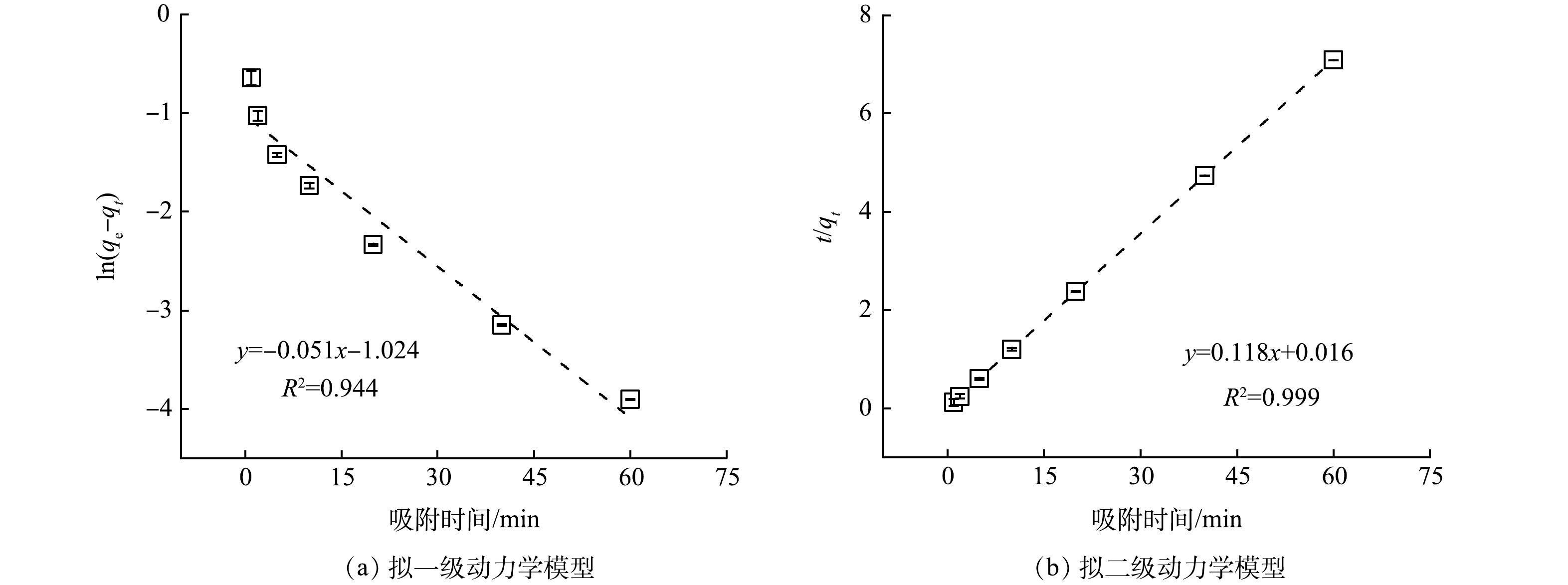
Cs+浓度及去除率随时间变化的关系如图1所示。在1 min内,Cs+质量浓度从4.31 mg·L−1降低至0.33 mg·L−1,去除率高达92.42%;当吸附时间大于10 min,溶液中Cs+浓度几乎保持不变,去除率维持在96.50%以上。由此可见,KZTS-NS对Cs+具有优异的吸附动力学特性,仅需10 min即可达到平衡。为了进一步探究KZTS-NS吸附Cs+的限速步骤,分别采用了拟一级动力学模型和拟二级动力学模型对动力学数据进行线性拟合,拟合结果如图2所示。拟一级动力学模型的拟合参数为qe=0.36 mg·g−1,k1=0.05 min−1,R2=0.944;拟二级动力学模型的拟合参数为qe=8.48 mg·g−1,k2=0.87 g·mg−1·min−1,R2=0.999;qe实验值为8.49 mg·g−1。结果表明,拟二级动力学模型可以更好地反应KZTS-NS对Cs+的吸附过程,R2高达0.999,且由拟二级动力学模型算出的平衡吸附量与实验值相近。这说明KZTS-NS对Cs+的吸附为化学吸附。快速的吸附动力学是KZTS-NS所具有的显著特性之一,这是活性炭[15]、红泥和软锰矿[16]等吸附材料所不具有的,三者吸附平衡时间分别为8、4和24 h[15-16]。该特性也可见于NMTS(平衡时间为3 min)[17]、KZrTS(平衡时间为1 min)[18]和KAlSnS-3(平衡时间为15 min)[10]等金属硫化物材料。超快的动力学特性对放射性废水的应急处置具有重要意义。
-
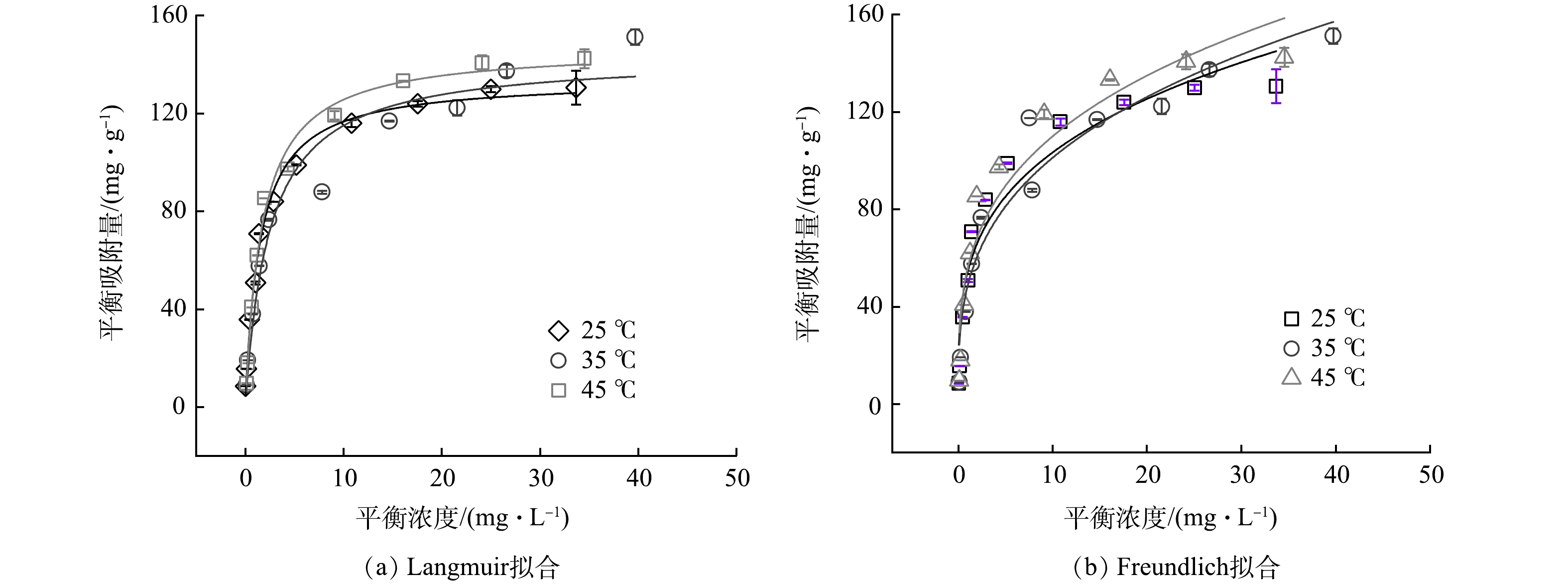
KZTS-NS在不同温度下对Cs+的吸附等温线如图3所示。由图3可见,在等温条件下,KZTS-NS对Cs+的平衡吸附容量在平衡浓度为0~10 mg·L−1内快速上升,在10~20 mg·L−1内缓慢增加,最后在20 mg·L−1之后逐渐饱和,且吸附容量随温度的升高而增加,表明温度的增加有利于KZTS-NS对Cs+的吸附。以KZTS-NS吸附Cs+之后的平衡浓度为横坐标,以平衡时KZTS-NS对Cs+的吸附量为纵坐标,使用Langmuir和Freundlich模型对数据进行拟合,2种模型的结果如图3(a)和图3(b)所示,拟合的参数见表1。
由表1可知,相比于Freundlich模型,Langmuir模型的拟合效果更优。前者的R2为0.954~0.992,而后者的R2则小于0.937。这表明KZTS-NS对Cs+的吸附符合Langmuir吸附等温模型。通常Langmuir模型用来描述均匀的吸附过程;而Freundlich模型则用来描述非均匀的吸附过程[19]。以上结果表明,KZTS-NS对Cs+的吸附过程属于单层吸附。由表1还可以看出,KZTS-NS对Cs+的最大吸附容量在25 ℃下为133.96 mg·g−1,高于许多已报道Cs+吸附剂。表2总结了几种吸附剂对Cs+的吸附容量。可见,KZTS-NS对Cs+的吸附容量显著高于硅藻土、蒙脱石等天然矿物,且与FJSM-SbS、FJSM-SnS-3等硫化物相当。另外,值得注意的是,25 ℃下的qm仅占理论吸附容量(229.09 mg·g−1,见2.8.2小节)的58.47%。这可能是由于进入KZTS-NS层间的Cs+的离子半径较大,因此,层间空间无法容纳与K+化学计量数相当的Cs+,导致Cs+的最大吸附容量小于理论上的吸附容量。该现象也可见于KMS-1[20]。
-
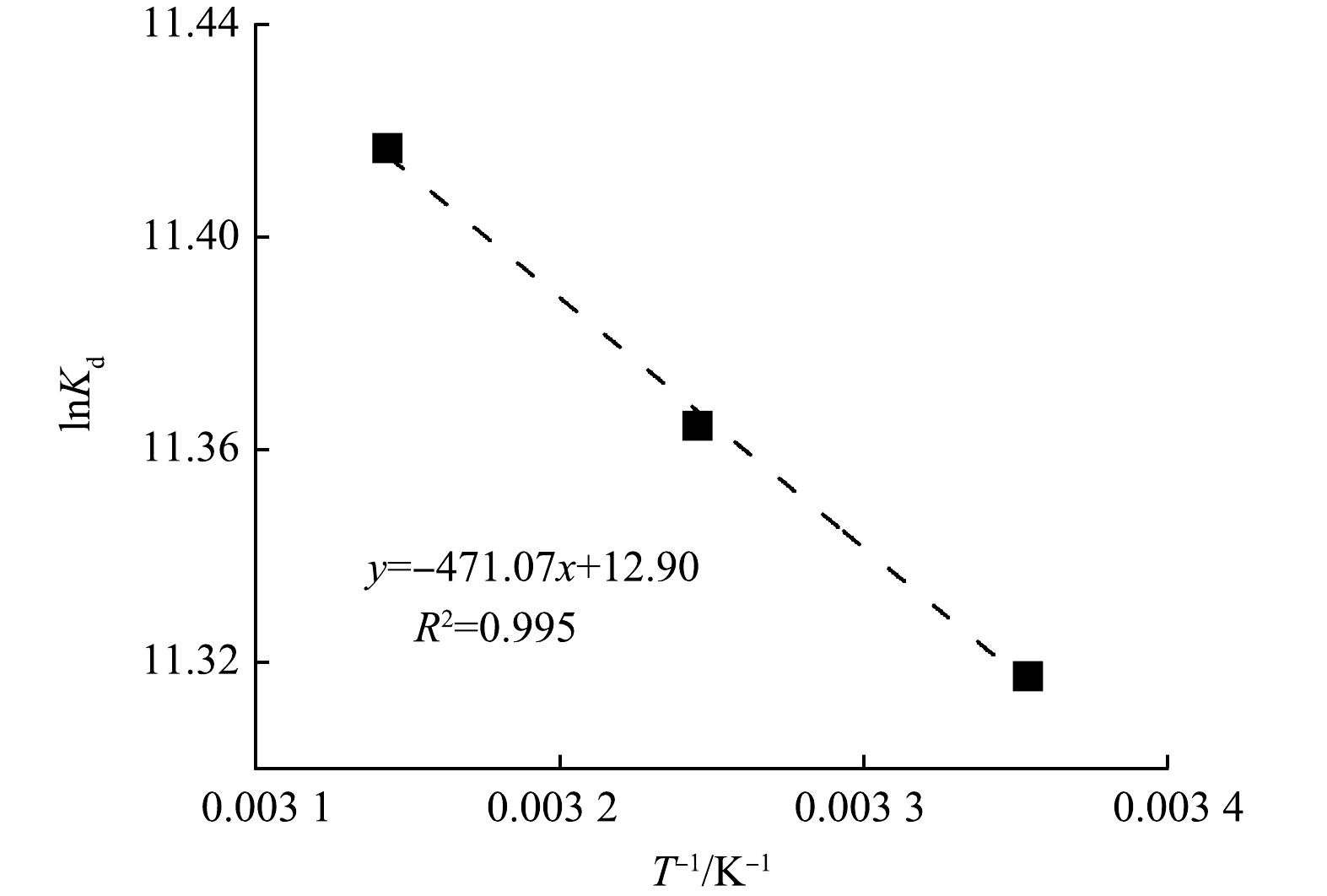
为了进一步探究KZTS-NS对Cs+的吸附热力学特性,以1/T为横坐标,以lnKd为纵坐标对吸附热力学数据进行拟合,拟合结果如图4所示。由图4可知,lnKd与1/T具有良好的线性关系,R2达到0.995。根据式(6)可知,ΔHθ和ΔSθ可以通过拟合方程的斜率和截距计算得出,而ΔGθ则通过式(5)计算得出。KZTS-NS在不同温度下对Cs+的吸附热力学参数如表3所示。由表3可知,吸附反应在25、35和45 ℃下的ΔGθ均为负值,分别为−28.05、−29.12和−30.20 kJ·mol−1,且ΔGθ的绝对值随着温度的升高而增加。这表明KZTS-NS对Cs+的吸附能够自发进行,且温度越高越有利于该反应的进行。ΔHθ和ΔSθ均大于0,因此,KZTS-NS对Cs+的吸附过程是一个吸热且熵增的过程。
-
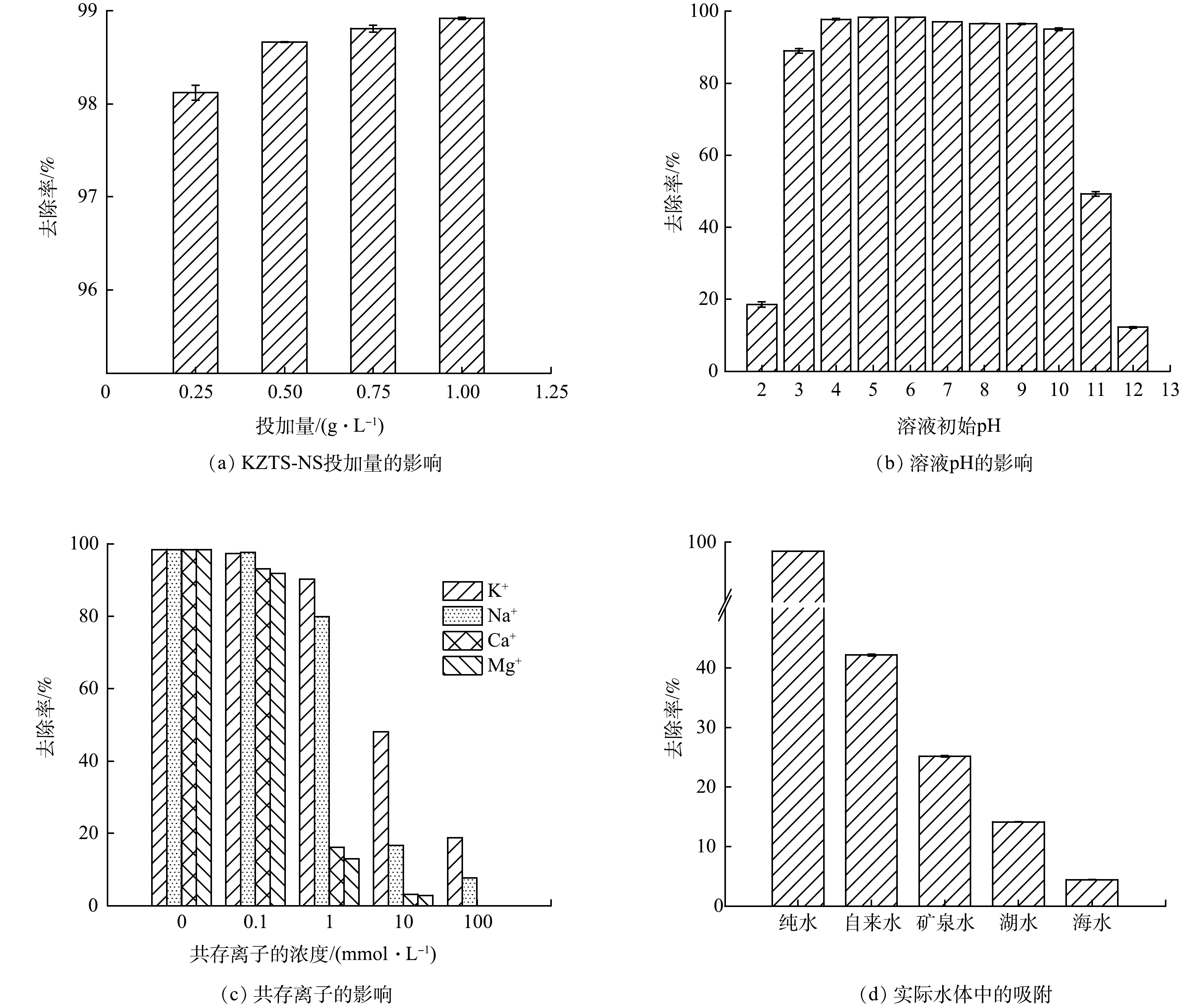
如图5(a)所示,不同的KZTS-NS投加量与溶液中Cs+的去除率有相关关系。一般来说,在溶液中投加越多的吸附剂,污染物的去除效率也就越高。在图5(a)可以看出,当KCTS-NS的投加量为0.25 g·L−1时,Cs+的去除率为98.12%;当投加量增加到0.5 g·L−1时,Cs+的去除率达到了98.66%;继续增大投加量,去除率几乎维持不变。但如果过多地投加吸附剂,将会带来浪费与污染问题。当KZTS-NS的投加量超过0.5 g·L−1,Cs+的去除效率基本保持恒定,说明此时KZTS-NS的吸附容量尚未得到充分的利用。为了避免吸附剂浪费,在实验条件下选择的投加量为0.5 g·L−1,这样既能够有效的去除Cs+,又能够节省吸附剂。
-
图5(b)是溶液pH对KZTS-NS吸附Cs+的影响。由图5(b)可知,溶液pH的变化对KZTS-NS的吸附性能影响较小,在pH为3~10,KZTS-NS都能够保持较好的吸附效果。这说明KZTS-NS具有较好的耐酸碱性,具有pH较广的应用范围。天然水体(如海水、地表水、地下水等)的pH一般在3~10。因此,就溶液pH而言,KZTS-NS可适用于天然水体放射性Cs+污染处理。需要指出的是,当溶液pH为2、11、12时,Cs+的去除率大幅降低。这可能是由于在强酸或强碱环境下,吸附剂的层间结构被破坏,导致吸附效果急剧下降[13]。因此,在使用该金属硫化物处理强酸性废水时,需对废水进行预处理使其达到合适的pH条件。
-
此外,还考察了实际水体中4种常见的共存离子(K+、Na+、Ca2+、Mg2+)对KZTS-NS吸附Cs+的影响,以评估KZTS-NS处理实际水体的适用性。如图5(c)所示,在共存离子浓度低于0.1 mmol·L−1时,KZTS-NS的吸附性能几乎不受影响;当溶液中共存离子的浓度从0.1 mmol·L−1增加到1 mmol·L−1时,KZTS-NS受到Ca2+、Mg2+的影响较大,Cs+去除效率分别从93.00%和91.82%降低至16.14%和13.02%。这可能是因为较高浓度Ca2+、Mg2+会与溶液中的Cs+竞争吸附剂上的吸附位点。相比于单价离子,表面带负电的KZTS-NS对Ca2+和Mg2+有更强的静电效应[31],因此,受到这些离子的干扰较大。此外,由于K和Cs位于同一主族且化学性质相近,当两者同时存在于溶液中时,不易相互分离。而KZTS-NS在1 mmol·L−1 K+、Na+存在情况下,对Cs+保持着90.22 %和79.82 %的去除率,说明KZTS-NS对Cs+的选择性高于K+、Na+。该特性有利于处理K+、Na+浓度低于1 mmol·L−1的放射性废水。当溶液中K+、Na+浓度增加到10 mmol·L−1时,KZTS-NS对Cs+的去除率分别为48.11%和16.69%。若K+浓度进一步增加到100 mmol·L−1,KZTS-NS对Cs+的去除率仍有18.85%。在实际放射性铯废水中,通常存在一定浓度的K+、Na+、Ca2+和Mg2+,其对KZTS-NS吸附性能的负面影响不容忽视。
-
为了进一步探索KZTS-NS直接用于处理实际水体的效果,分别选取了自来水、矿泉水、湖水和海水模拟不同水体中铯污染,并以纯水作为对照组。不同实际水体中阳离子质量浓度见表4。由图5(d)可知,在纯水中KZTS-NS对Cs+的去除率高达98.53%。在自来水中、矿泉水、湖水和海水中KZTS-NS对Cs+的去除率呈现出递减趋势,分别为42.14%、25.15%、14.14%和4.44%。这与各水体中所含的K+、Na+、Ca2+、Mg2+含量呈负相关。可见KZTS-NS对Cs+的去除率随水中共存阳离子含量的增加而降低。共存离子对吸附的负面影响同样可见其他金属硫化物材料中[17-18]。因此,在处理实际水体时,需要增加预处理工序以降低水中的共存离子浓度。例如,在福岛核事故中,由于海水倒灌,核事故产生的放射性废水含盐量较高。针对此情况,东电公司采用了化学沉淀法作为预处理方法对放射性废水进行脱盐处理,然后再通过吸附法去除废水中的放射性核素[8]。如何提高吸附材料对Cs+的选择性以实现实际水体(尤其是高盐水)中Cs+的高效去除仍是今后研究需要突破的瓶颈问题。
-
1) SEM分析。KZTS-NS吸附前后的SEM图像如图6所示。由图6可以看出所合成的KZTS-NS呈均匀纳米片形貌,且吸附后依然保持该形貌。根据前期研究,KZTS-NS吸附剂具有二维层状空间结构,该结构主要由带负电的Zn-Sn-S骨架层与带正电的K+构成。根据Pearson硬软酸碱理论[32],KZTS-NS骨架中的S2-配体属于软碱,对软酸(Sr2+、Cs+和UO42+等)具有天然的强亲和力,因此,对这些核素去除效果较好,是新颖的放射性废水吸附材料。层间的K+与S原子之间形成的K···S键较弱,因此,容易被Sr2+和Co2+等离子所交换[13-14]。基于此特性,推测KZTS-NS可能对Cs+也具有吸附能力,因此,对KZTS-NS吸附Cs+的特性和机理展开探索。
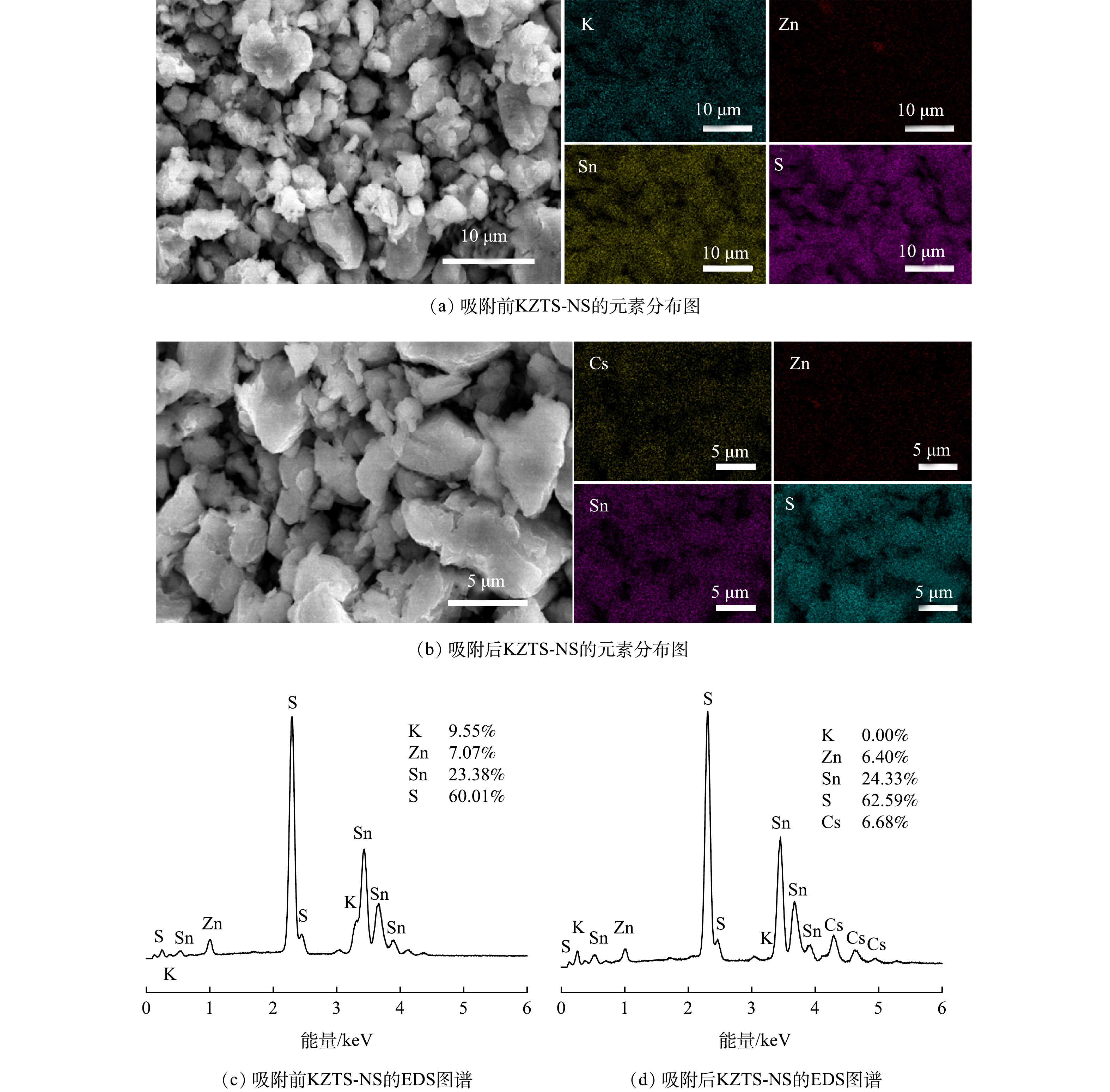
2) EDS及MAPPING分析。图7所示的是KZTS-NS对Cs+吸附前和吸附后的EDS及元素分布图。由图可见原始KZTS-NS吸附剂由K、Zn、Sn、S构成,且这4种元素在材料表面上分布均匀;K:Zn:Sn:S的原子比例为9.55:7.07:23.38:60.01。吸附Cs+后,可在吸附剂的表面观测到Cs元素(含量为6.68%),说明Cs+被成功吸附在KZTS-NS上,由此证实了前述KZTS-NS能够吸附Cs+的推测。此外,图7(d)所示的EDS图谱显示吸附后K原子含量占比为0.00,说明KZTS-NS层间的K+被Cs+完全交换。由此可知,KZTS-NS中的K+均可用于离子交换。从图7(c)所示的原子比例可算出,KZTS-NS中K原子的含量为1.72 mmol·g−1。当所有K被相同化学计量数的Cs取代时,KZTS-NS对Cs+的理论吸附容量应为229.09 mg·g−1。
3) XRD分析。吸附Cs+前后KZTS-NS的XRD谱图如图8所示。由图8可知,原始KZTS-NS特征峰位于2θ=9.62°和19.30°处,表现出典型层状材料的图谱,这与前期研究结果一致[13]。根据布拉格公式可以计算出,该材料位于2θ = 9.62°和19.30°的特征峰对应的晶格间距分别为9.19 Å和4.60 Å。吸附后特征峰往低角度方向发生偏移,对应的晶面间距增大。这可能是由于原来位于层间的K+被半径更大的Cs+所交换,导致层间距增大。该现象在其他研究中也有报道。例如,KMS-1[33]和KTS-3[34]吸附Cs+后特征峰也向低角度方向偏移。以上结果说明,K+和Cs+之间的离子交换可能是KZTS-NS吸附Cs+的主要机理。此外,XRD图谱中部分峰与SnS2相匹配,说明所制备的KZTS-NS含有少量SnS2,这可能是水热法合成产生的副产物,该现象在其他金属硫化物的合成过程中也被报道[35]。布拉格公式如式(10)所示。
式中:d为晶格间距,Å;λ为X射线入射波长,Å ;XRD 采用CuKα辐射,λ = 1.541 8 Å;2θ为XRD衍射峰位置,°。
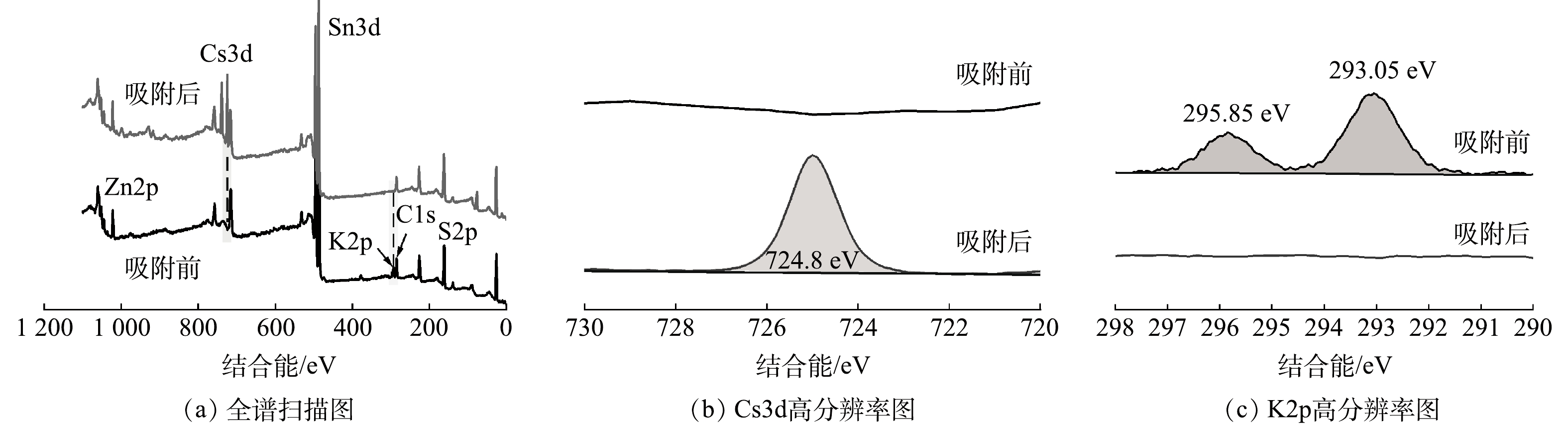
4) XPS分析。为了进一步分析KZTS-NS吸附Cs+的机理,用XPS对吸附Cs+前后的KZTS-NS材料进行了表征。吸附前KZTS-NS的XPS谱图如图9(a)的黑线所示。从图谱中可以看到K、Zn、Sn、S以及C元素的峰。其中C1s峰是外加碳源引起的,用于校正结合能,其标准结合能为284.8 eV;而K2p、Zn2p、Sn3d、S2p特征峰的出现则与元素分布结果(图7(a))一致,再次证实KZTS-NS由K、Zn、Sn和S组成。KZTS-NS吸附后的XPS图谱如图9(a)的红线所示。从吸附后的图谱中可以发现Cs3d的特征峰,该特征峰在高分辨率图谱中更为明显(图9(b)),说明KZTS-NS成功捕获了Cs+。这与XRD谱图主峰发生低角度偏移的结果相一致。图9(c)为K2p的高分辨率图谱。从该图可以看出吸附后K2p的峰完全消失,说明位于KZTS-NS层间的K+被Cs+完全交换。在图7(d)中也可以观察到K原子占比为0,与XPS结果一致。综上所述,KZTS-NS是通过其上K+和溶液中Cs+之间的离子交换而吸附Cs+,并且KZTS-NS上的K+可完全被Cs+所交换。
5)吸附机理分析。为了进一步验证K+和Cs+之间的离子交换机理,研究了不同温度下KZTS-NS吸附Cs+的量与KZTS-NS中K+的脱附量之间的关系。以吸附Cs+的量为横坐标、吸附后KZTS-NS在溶液中脱附K+量为纵坐标,画出二者的关系图并进行相关性分析,结果如图10(a)所示。由图10(a)可知,吸附Cs+的量和脱附K+的量相关性较强,不同温度下拟合的相关系数(R2)均高于0.941,并且拟合直线的斜率均接近于1。这说明KZTS-NS在吸附过程中,每吸附1 mol的Cs+,就会有1 mol的K+从KZTS-NS上脱附到水溶液中,再次证实Cs+和K+之间的离子交换是KZTS-NS吸附Cs+的主要机理(图10(b))。
-
1) KZTS-NS对Cs+具有快速的吸附动力学特性,10 min即可达到平衡,吸附等温线符合Langmuir模型,最大吸附容量为133.96 mg·g−1,KZTS-NS对Cs+的吸附是个自发、吸热且熵增的过程。
2) KZTS-NS具有良好的环境适应性,能够在pH为3~10内保持较好的吸附性能,并且在共存离子存在下对Cs+具有较好的吸附能力,溶液中共存离子对吸附性能的影响排序为Mg2+>Ca2+>Na+>K+。
3) KZTS-NS对受放射性Cs+污染的实际水体具有一定的处理能力,在自来水中、矿泉水、湖水和海水中对Cs+的去除率分别为42.14%、25.15%、14.14%和4.44 %。
4) KZTS-NS具有纳米片状形貌,K、Zn、Sn、S元素在材料表面上分布均匀且原子比例为9.55:7.07:23.38:60.01,吸附Cs+后K原子在材料中占比为0。KZTS-NS对水中Cs+的吸附机制为K+和Cs+之间的离子交换,材料上的K+可完全被Cs+交换。
Adsorptive removal performance and mechanism of cesium ion from aqueous solutions by a K/Zn/Sn/S metal sulfide
- Received Date: 26/06/2023
- Available Online: 26/01/2024
-
Key words:
- metal sulfide /
- adsorbent /
- cesium /
- radioactive contamination /
- ion exchange
Abstract: A nanosheet-like K/Zn/Sn/S metal sulfide (KZTS-NS) was synthesized by a hydrothermal method. The adsorption properties and mechanism of KZTS-NS towards Cs+ was investigated. The results showed that fast adsorption of Cs+ occurred by KZTS-NS with an equilibrium time of only 10 minutes and Cs+ removal rate of 96.50%. The adsorption isotherms were well fitted with the Langmuir model, and the calculated maximum adsorption capacity reached 133.96 mg·g−1, which was higher than other reported adsorbents. The adsorption of Cs+ by KZTS-NS was a spontaneous, endothermic, and entropy-increasing process. KZTS-NS had a good performance on Cs+ adsorption in the pH range of 3-10. The inhibitory effect of coexisting ions on Cs+ adsorption by KZTS-NS followed the sequence of Mg2+>Ca2+>Na+>K+. The removal rates of Cs+ by KZTS-NS in tap water, mineral water, lake water, and seawater were 42.14%, 25.15%, 14.14%, and 4.44%, respectively. The KZTS-NS before and after cesium ion (Cs+) adsorption was characterized using scanning electron microscopy (SEM), X-ray diffraction (XRD), and X-ray photoelectron spectroscopy (XPS), etc. to reveal the Cs+ adsorption mechanism. Results showed that the nanosheet-like morphology of KZTS-NS remained unchanged before and after adsorption of Cs+. K, Zn, Sn, and S elements were evenly distributed on the surface of KZTS-NS. The XRD characteristic peaks after Cs+ adsorption shifted towards a lower 2θ value, corresponding to an increase in crystal plane spacing. The XPS spectra and quantitative analysis indicated that the adsorption mechanism of KZTS-NS for Cs+ was ion exchange. In summary, KZTS-NS could rapidly and efficiently remove Cs+ from wastewater and showed a great potential for further application. This study provides a technical reference and the basic data supports for the treatment of wastewater containing radioactive Cs+ ions.








 DownLoad:
DownLoad:
