-
页岩气开采过程中,目前最重要的增产方法是水平井大规模水力压裂技术[1]。向储层注入含有酸、破胶剂、阻垢剂等添加剂的压裂液后,压裂液与页岩会发生多种化学反应[2]。国内外学者已经对给定条件下的压裂液-页岩作用开展了诸多研究,但不同地区的页岩组分、储层环境和压裂液成分并不相同,导致研究结果存在差异,主要体现在页岩结构改变形式、返排液组分演化规律等方面[3-4]。水力压裂结束后产生的返排液中含有各种有机物、放射性元素、有害元素等[5-6],现有技术很难经济合理的处置[7],如果发生泄漏,将给地下水环境带来严重的污染风险。
压裂液-页岩作用存在于整个水力压裂过程中,受页岩组分、储层环境和压裂液成分的共同影响,导致返排液组分十分复杂。水力压裂过程中,向储层注入压裂液前通常采用浓盐酸预处理井筒[8],pH的变化可能影响压裂液-页岩作用。储层埋深不同时,环境温度也随之改变,从而影响页岩中矿物的氧化还原速率、溶解速率和溶解度。地层水和回用返排液的存在可以改变压裂液离子强度[9],影响反应中各元素的溶出。同时,压裂液-页岩作用还受压裂液与页岩接触面积的影响。此外,为提高水力压裂效率,压裂液中含有多种添加剂,这可能导致压裂液化学性质的变化,对压裂液-页岩作用产生影响。中国页岩气开发仍处于初始阶段,已经开展的研究中考虑的仅是部分环境因素和压裂液成分的影响,与实际水力压裂过程中的压裂液-页岩作用有所差别,因此研究还不充分。
为揭示储层环境和压裂液成分对压裂液-页岩作用的影响,本文选择四川某页岩气产区的龙马溪组页岩,通过室内实验研究了不同环境因素(初始pH、温度等)和压裂液成分(过硫酸铵、柠檬酸等)影响条件下,页岩组分在液-岩作用过程中的释放特征。以期为探究储层环境中的压裂液-页岩作用机理提供一定依据,对预测返排液组分和防治地下水污染具有重要意义。
-
实验采用龙马溪组露头部分的新鲜页岩,其主要组分包括石英、碳酸盐矿物、黄铁矿、粘土矿物等(表1)。在室内干燥环境中,将页岩加工制成200目粉末。
-
实验中使用的溶液均由超纯水配制,溶液pH用0.1 mol·L−1的NaOH和0.1 mol·L−1的HCl调节,溶液离子强度用NaCl(分析纯,北京化工厂)调节。
通过批实验研究了溶液初始pH、温度、离子强度和固液比对水-页岩作用的影响(表2)。实验过程中所有反应容器保持密封状态。初始pH、离子强度和固液比影响实验中,反应容器为50 mL离心管(聚丙烯材质),在恒温摇床(175 r·min−1,25 ℃)上振荡。温度影响实验中,反应容器为100 mL具塞锥形瓶(玻璃材质),在恒温磁力搅拌器(200 r·min−1)中进行。为研究页岩组分释放特征随时间的变化,在反应开始后1、6、12、24、72、168 h时采集样品。将样品离心(3000 r·min−1,雷勃尔,中国)7 min后,迅速测量pH值。取10 mL上清液通过0.45 μm滤膜(PES)并加1∶1 HNO3酸化至pH<2.0,用来测试样品中的阳离子,测试仪器为电感耦合等离子体光谱发生仪(ICP-OES BLUE);剩余上清液不添加任何保护剂直接保存,用来测试样品中的阴离子,测试仪器为Metrohm 877 Titrino plus电位滴定仪和离子色谱(ICS-900)。
-
实验采用水力压裂过程中常用的破胶剂、控铁剂、阻垢剂和pH调节剂,过硫酸铵、柠檬酸、乙二醇和碳酸钾(分析纯,北京化工厂),与超纯水配制成3种简单压裂液。0.075 mm和1—2 mm两种粒径的龙马溪组页岩添加比例为3∶2。
通过批实验将超纯水和3种简单压裂液分别与页岩反应,固液比为50 g·L−1,实验编号分别为A、B、C和D(表3)。反应容器为100 mL具塞锥形瓶(玻璃材质),瓶内空气部分体积约为25 mL,实验过程中保持密封状态。实验在恒温水浴锅(70 ℃,力辰科技电热数显恒温水浴锅HH-2)中进行。样品采集时间和测试方法同“1.2”节。
-
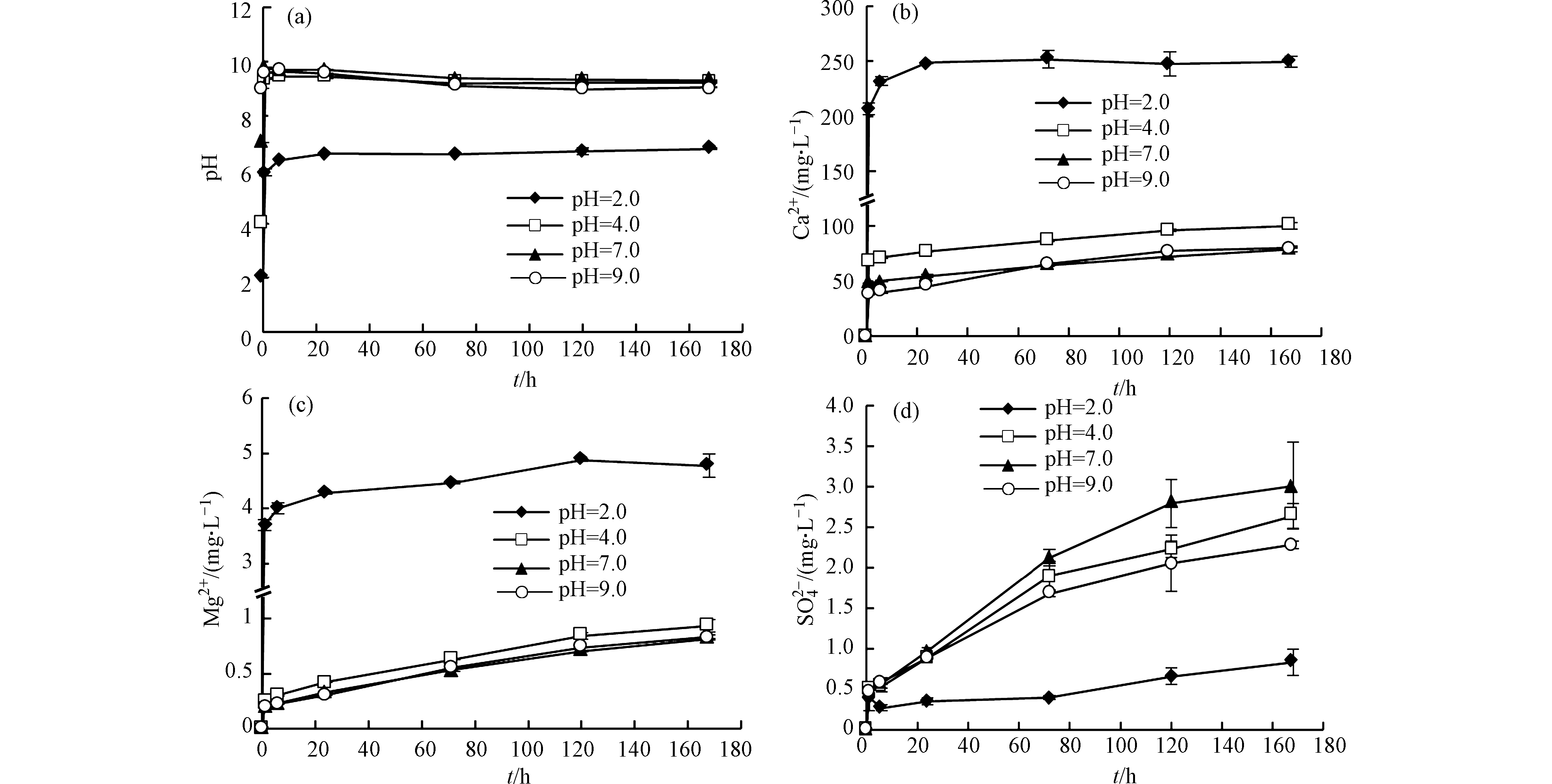
溶液初始pH对多种元素的溶出有明显影响,较低pH条件下元素溶出量较大(Ca、Mg、Mn、Sr等)。溶液初始pH值为2.0时,Ca2+和Mg2+的浓度最高,随着初始pH升高,溶出量整体呈下降趋势(图1b、图1c)。由于页岩中的Ca和Mg主要存在于方解石和白云石中(表1),说明碳酸盐矿物溶解随溶液初始pH升高而降低。Wang等[10]通过研究水化学对Eagle Ford页岩中元素迁移的影响,也发现Ca和Mg的释放强烈依赖于pH。碳酸盐矿物溶解可以迅速中和酸性溶液,同时产生大量的Ca2+和Mg2+,抑制方解石和白云石继续溶解,因此碳酸盐溶解是控制溶液pH变化的主要因素[11]。初始溶液为强酸环境(pH=2.0)时,溶液pH值在前6 h内快速达到6.4左右,然后不断升高,最后保持在6.8附近;初始溶液为弱酸、中性和弱碱环境(pH=4.0、7.0和9.0)时,溶液pH值在前6 h内达到9.6左右,然后逐渐降低,最后保持在9.2附近(图1a)。不同反应体系中,反应后期溶液酸碱性差异相比于初期减小很多。
初始溶液为强酸环境时,Ca2+浓度在反应初期快速达到最高值(图1b),表明方解石迅速溶解;Mg2+浓度在整个反应过程中呈上升趋势(图1c)。反应后期,Mg2+含量增加而Ca2+沉淀,这可能是去白云岩化作用导致的[12]。反应体系中检出的阴离子主要有
${\rm{SO}}_4^{2-} $ 和Cl−。溶液初始pH值为2.0时${\rm{SO}}_4^{2-} $ 浓度最低(图1d),且溶液中Ca2+与${\rm{SO}}_4^{2-} $ 的离子活度积接近石膏的溶度积,因此含钙沉淀可能是CaSO4·2H2O。Marcon等[13]和Dieterich等[14]在实验中也发现了石膏沉淀。实验结果表明,多种元素溶出受溶液初始pH的明显影响。酸性环境有利于碳酸盐矿物溶解,溶液pH变化主要受碳酸盐溶解控制。强酸环境中方解石迅速溶解释放大量Ca2+,在溶液中形成较高的Ca/Mg值,导致反应后期容易发生去白云岩化作用,产生含钙沉淀。
-
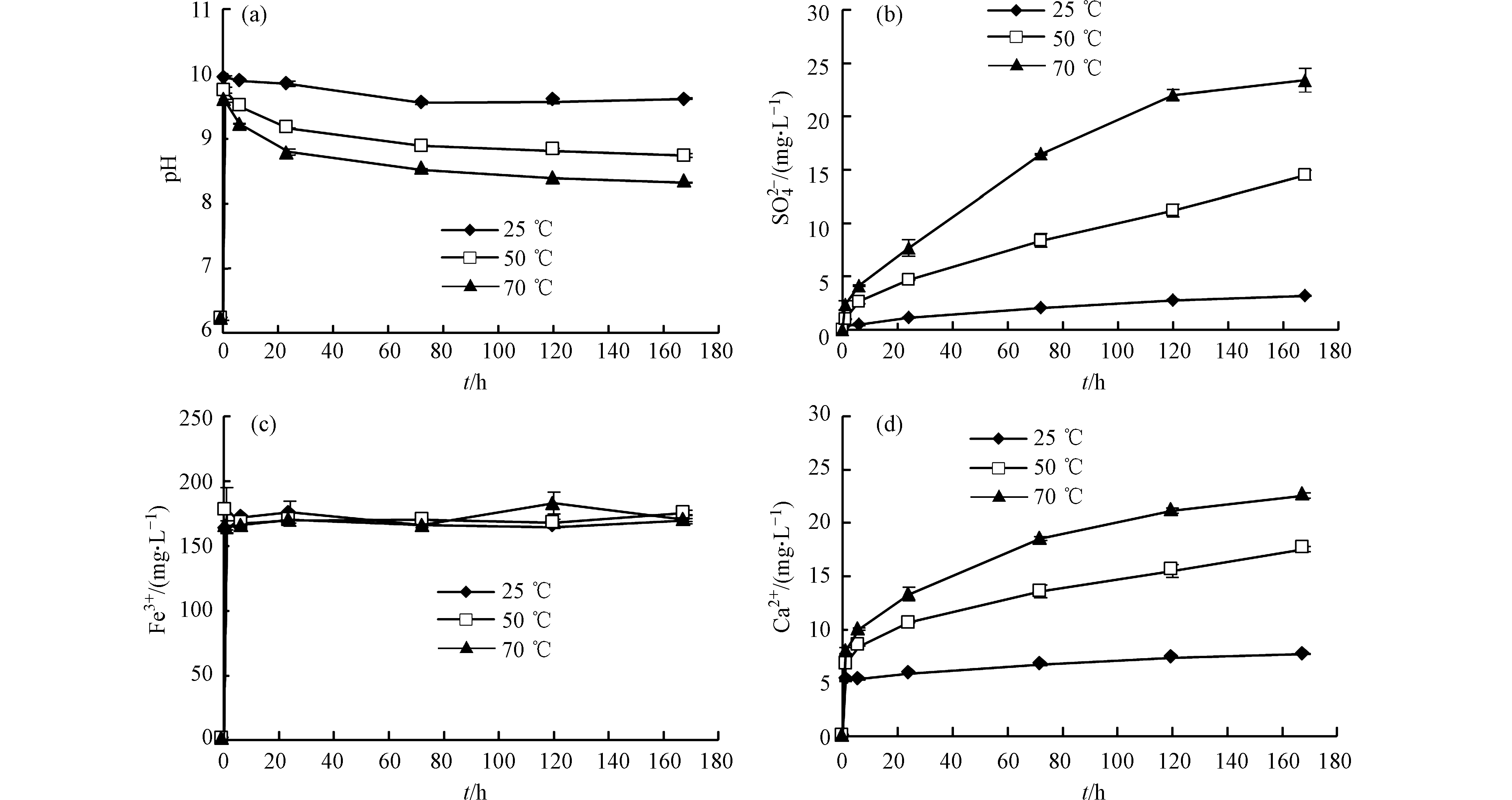
反应过程中
${\rm{SO}}_4^{2-} $ 浓度不断上升,且温度越高释放速率和溶出量越大(图2b)。由式(1)可知,溶液中的${\rm{SO}}_4^{2-} $ 主要来源于黄铁矿氧化,说明温度升高会导致黄铁矿氧化速率增加。除${\rm{SO}}_4^{2-} $ 外,黄铁矿氧化还会产生Fe3+。不同于${\rm{SO}}_4^{2-} $ ,Fe3+浓度在反应前6 h内快速上升,然后基本保持不变(图2c)。不同温度条件下的溶液pH值均大于8.0(图2a),同时测得溶液Eh>0。当溶液pH>5.0且Eh>0时,Fe的存在形式主要是Fe(OH)3[15],因此温度对Fe3+浓度的影响不明显,黄铁矿氧化反应如式(2)所示。此外,温度对很多元素溶出的影响不大(V、Cr、Ga、Tl等)。不同温度条件下,Ca2+和
${\rm{SO}}_4^{2-} $ 的变化趋势基本相同(图2d、图2b),但反应初期Ca2+浓度快速上升,这可能是页岩中含有其他易溶含钙金属盐及CO2溶于水与碳酸盐反应导致的[16-17]。溶液中检出的阴离子主要有${\rm{SO}}_4^{2-} $ 、${\rm{CO}}_3^{2-} $ 、${\rm{HCO}}_3^{-} $ 和Cl−。假设除碳酸盐外的易溶含钙金属盐为CaCl2,反应168 h后,根据Cl−溶出量得出各实验中CaCl2溶解释放的Ca2+均不足0.65 mg·L−1,这远小于反应初期溶液中Ca2+浓度的增量,说明CO2溶于水与碳酸盐反应是影响初期Ca2+含量的主要因素。由于初期易溶含钙金属盐迅速溶解,且实验处于密封环境,反应体系中CO2含量有限,导致Ca2+浓度不能随时间不断增加。因此反应后期,Ca2+主要来自黄铁矿氧化产生的H+与碳酸盐反应,如式(3)和式(4)所示。可以看出,温度升高有利于黄铁矿氧化,但Fe在溶液中的存在形式主要是Fe(OH)3,导致Fe3+浓度受温度影响不明显。同时,很多元素溶出受温度的影响不大。反应初期CO2是影响溶液中Ca2+浓度的主要因素,后期黄铁矿氧化产生的H+能够促进碳酸盐矿物继续溶解。
-
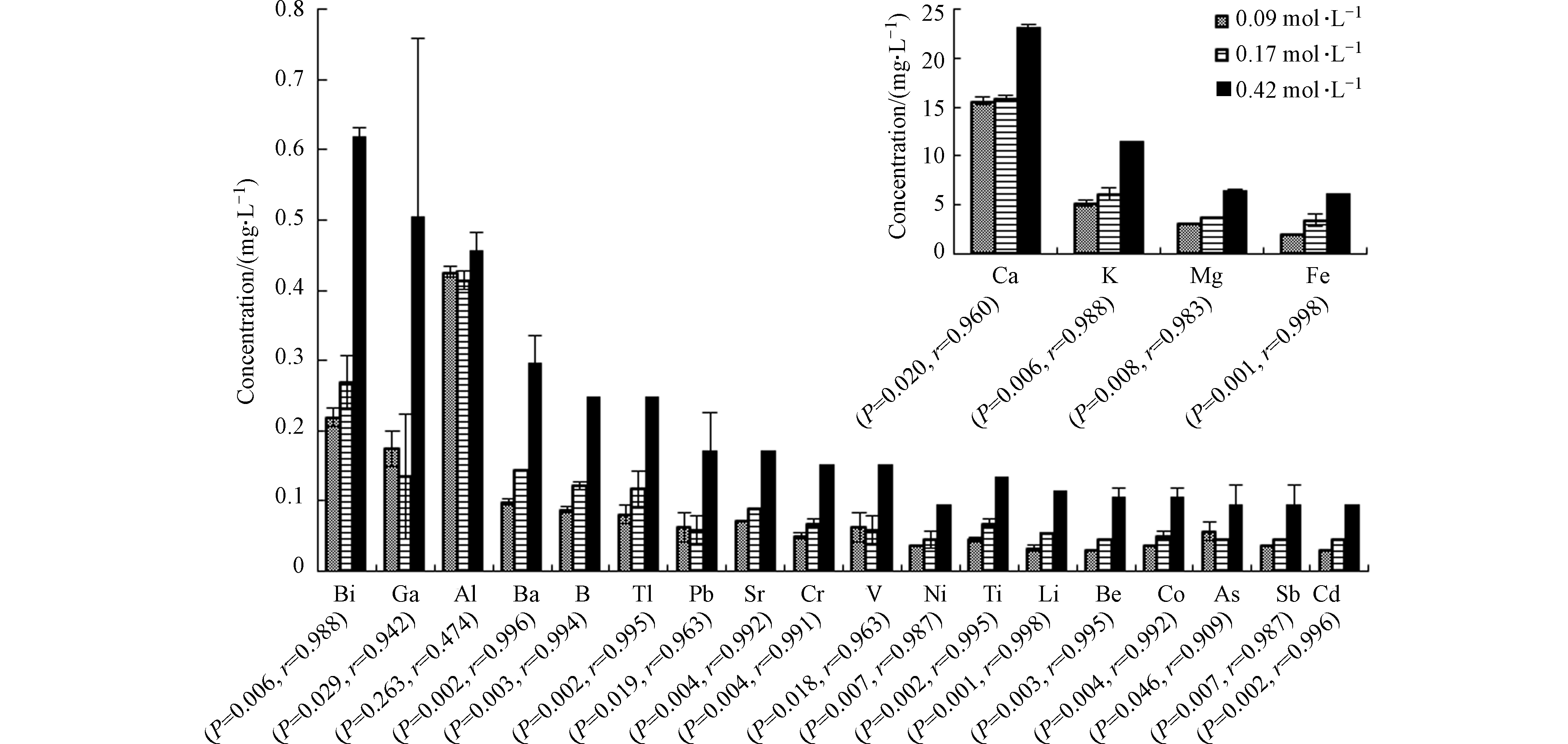
溶液离子强度对大多数元素的溶出有显著影响,离子强度增加有利于金属元素溶出。通过分析各元素与离子强度间的皮尔森相关性统计结果,发现除Al外的其他元素均与离子强度相关性极强(r>0.9且P<0.05)(图3)。
对Pb、Cr、As、Cd等微量金属元素,由于实验采用NaCl控制离子强度,高离子强度环境中大量的Na+会占据矿物上的吸附位点,导致矿物表面带负电的电位减少。Na+与各微量元素间会发生竞争吸附,从而降低粘土矿物对金属离子的吸附能力[18-19],有利于页岩释放金属离子。
反应体系中溶液pH>5.0且Eh>0,Fe主要以Fe(OH)3的形式存在,即溶液中Fe3+浓度应处于较低水平且变化不大,但实际上Fe3+浓度随离子强度增加而上升。原因是高离子强度会降低Fe3+活度,增加Fe(OH)3溶解度,使更多的Fe3+能够富集在溶液中。同样,BaSO4在高离子强度环境中溶解度也随之增大[20],符合实验中Ba2+浓度的变化趋势。这与Renock等[21]的研究结果一致。溶液中Ca2+和Mg2+的含量随离子强度的变化也表明高离子强度能够促进碳酸盐矿物溶解。
不同于其他元素,Al3+浓度随溶液离子强度增加而下降,但在离子强度为0.42 mol·L−1的条件下,Al3+浓度又突然升高。溶液离子强度增加导致Cl−含量增多,大量的Cl−会影响Al(OH)3的溶解速率[22],同时高离子强度环境会降低Al3+活度,使Al3+在反应体系中可以大量存在。因此高离子强度条件下,Al3+浓度的变化是多种反应共同作用的结果。
因此,大多数元素溶出受溶液离子强度的显著影响。离子强度增加有利于除Al3+外其他金属离子的溶出,同时能够促进Fe(OH)3、BaSO4等难溶化合物及碳酸盐矿物的溶解。
-
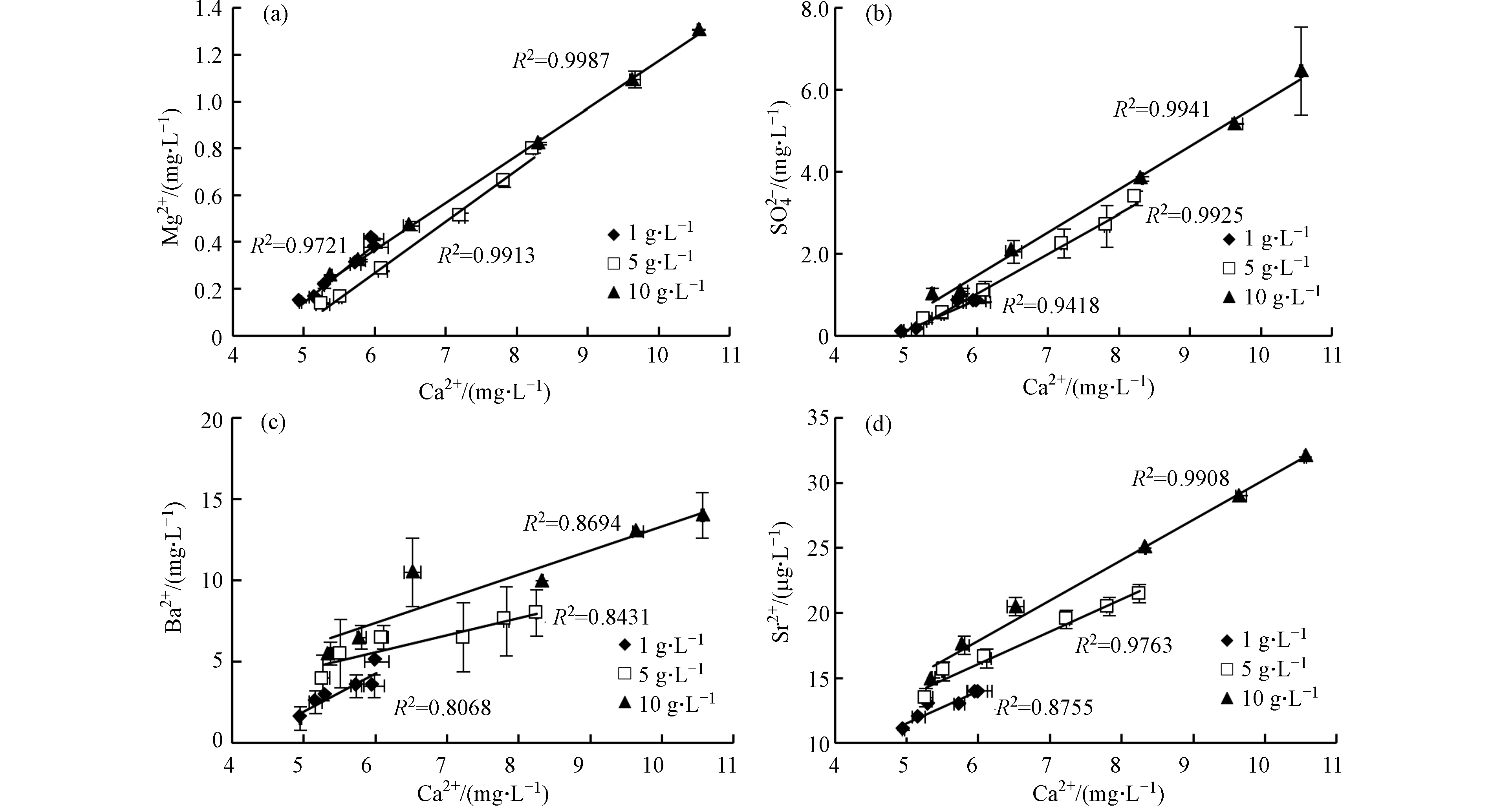
固液比对不同元素溶出的影响不同。固液比越高Ca2+、Mg2+和
${\rm{SO}}_4^{2-} $ 浓度越高(图4a、图4b),说明高固液比环境有利于碳酸盐矿物溶解和黄铁矿氧化。不同固液比实验中Ca2+与Mg2+和${\rm{SO}}_4^{2-} $ 均呈线性增长,R2均大于0.9,且变化趋势基本相同。说明方解石和白云石呈等比例溶解,固液比变化对碳酸盐矿物溶解速率的影响很小。${\rm{SO}}_4^{2-} $ 浓度越高表明黄铁矿氧化越多,由式(3)和式(4)可知,黄铁矿氧化产生的H+能够促进碳酸盐溶解,导致Ca2+含量增加,因此Ca2+与${\rm{SO}}_4^{2-} $ 存在一定的线性关系(图4b)。各实验中Ca2+与Ba2+和Sr2+的比值并不相同(图4c、图4d)。页岩中的Ba2+主要存在于被矿物填充的天然裂隙中[23],且Sr2+的释放主要与碳酸盐矿物溶解有关[24]。因此,碳酸盐溶解对Ba2+和Sr2+溶出的影响很大,导致Ca2+与Ba2+和Sr2+均存在一定的线性关系。但页岩的非均质性极强,造成金属元素随碳酸盐矿物溶解呈非等比例释放,因此Ba2+和Sr2+与Ca2+的线性关系较差。
总而言之,不同元素溶出受固液比的影响不同。高固液比环境有利于碳酸盐矿物溶解和黄铁矿氧化,促进Ba、Sr等微量元素的溶出。
-
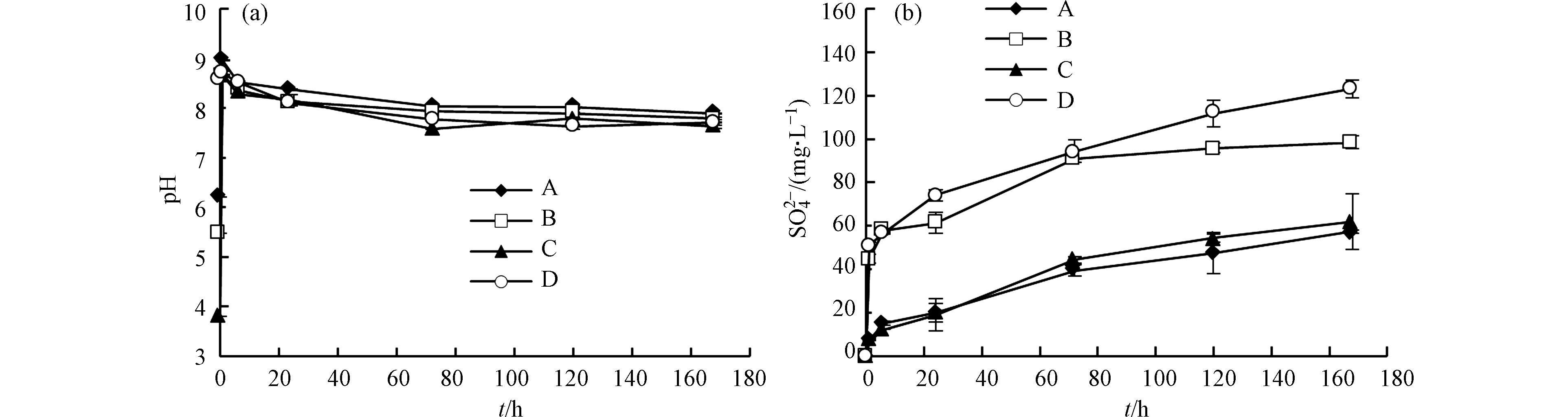
反应前72 h内
${\rm{SO}}_4^{2-} $ 浓度快速上升,然后不断增加,且添加过硫酸铵的实验(实验B和实验D)中,反应初期${\rm{SO}}_4^{2-} $ 浓度明显高于未添加过硫酸铵的实验(实验A和实验C);反应72 h后,实验C和实验D中${\rm{SO}}_4^{2-} $ 的释放速率基本稳定,实验A和实验B中${\rm{SO}}_4^{2-} $ 的释放速率逐渐减小(图5b)。溶液中的
${\rm{SO}}_4^{2-} $ 主要来自过硫酸盐还原和黄铁矿氧化。超纯水实验(实验A)和添加柠檬酸的实验(实验C)中,${\rm{SO}}_4^{2-} $ 主要来源于黄铁矿氧化,如式(1)所示。添加柠檬酸的实验(实验C)中,${\rm{SO}}_4^{2-} $ 的释放速率基本稳定,而超纯水实验(实验A)中,${\rm{SO}}_4^{2-} $ 的释放速率逐渐减小,这种差异与Fe3+活度有关。反应体系处于弱碱环境(图5a),Fe主要以Fe(OH)3的形式存在,而柠檬酸能够形成柠檬酸-Fe3+胶体抑制Fe3+沉淀[25],同时柠檬酸-Fe3+胶体也有利于黄铁矿氧化[26]。Gregory等[27]也认为压裂液中添加柠檬酸可以防止Fe沉淀。添加过硫酸铵的实验(实验B和实验D)中,
${\rm{SO}}_4^{2-} $ 主要来源于过硫酸铵还原和黄铁矿氧化,过硫酸铵还原反应如式(5)所示。反应24—168 h内,实验C和实验D中${\rm{SO}}_4^{2-} $ 的变化趋势基本相同(图5b),说明过硫酸铵在反应初期迅速消耗。因此,实验B和实验D中反应初期的${\rm{SO}}_4^{2-} $ 主要来自过硫酸铵还原,反应后期的${\rm{SO}}_4^{2-} $ 主要来自黄铁矿氧化。过硫酸铵能够增加溶液的氧化还原电势[28],促进黄铁矿氧化。Li等[29]的研究结果也表明氧化剂的存在有利于黄铁矿氧化。综上所述,过硫酸铵能够增加溶液的氧化还原电势,促进黄铁矿氧化,但过硫酸铵在反应初期基本全部消耗。柠檬酸能够形成柠檬酸-Fe3+胶体抑制Fe3+沉淀,同时促进黄铁矿氧化。
-
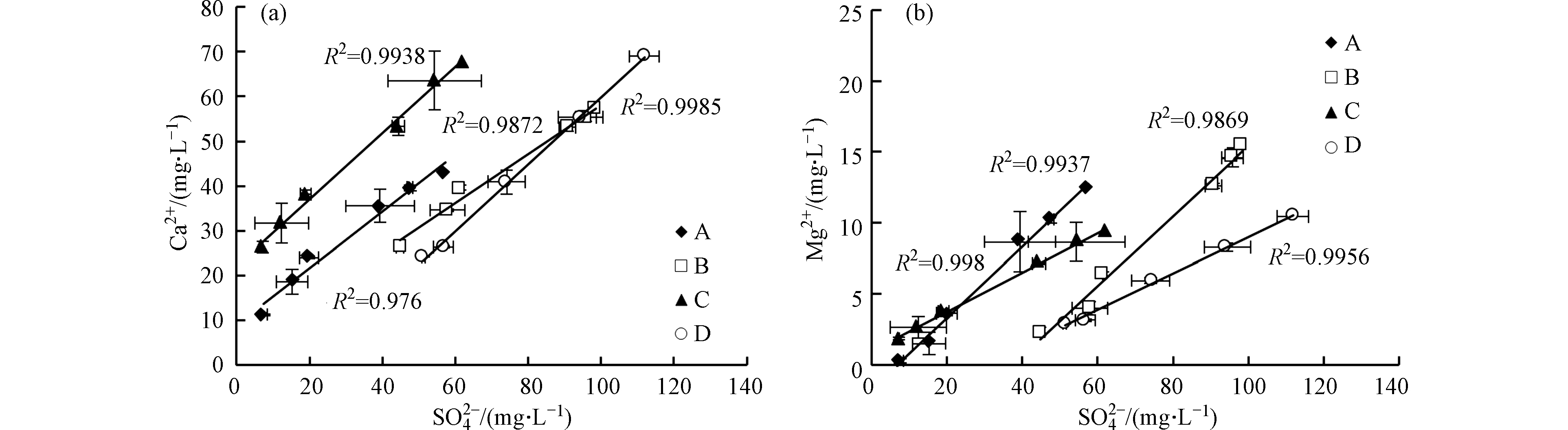
不同添加剂实验中
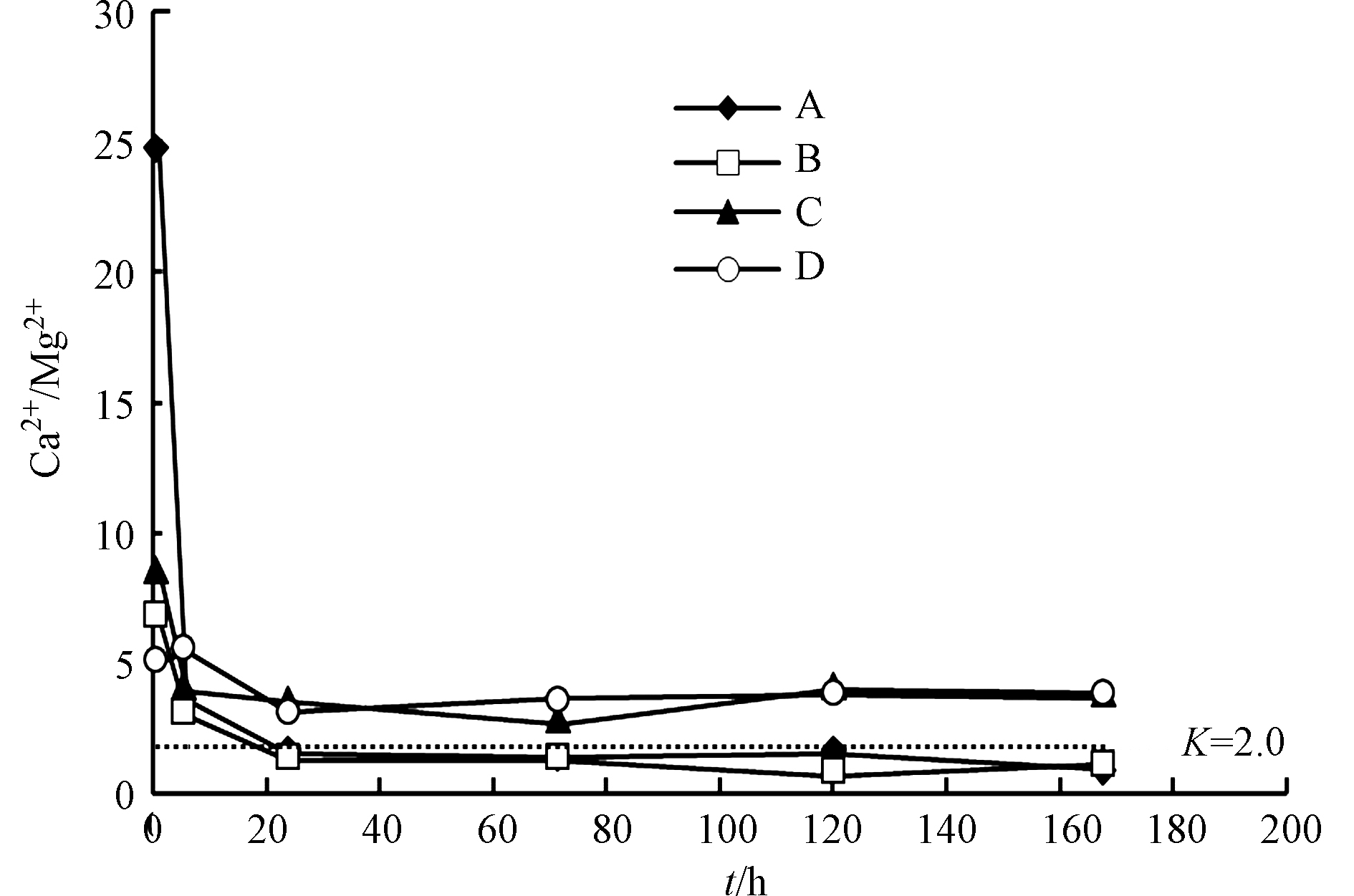
${\rm{SO}}_4^{2-} $ 与Ca2+和Mg2+均呈线性增长,R2均大于0.9(图6a、图6b),说明反应过程中碳酸盐矿物溶解消耗的H+主要来源于黄铁矿氧化。过硫酸铵和柠檬酸均有利于黄铁矿氧化,产生的H+能够促进碳酸盐溶解。溶液中的Ca2+和Mg2+主要来自方解石和白云石溶解(表1)。反应前6 h内,不同添加剂实验中单位时间Ca2+和Mg2+溶出量物质的量之比(K)不同,实验A>实验C>实验B>实验D,但均不断减小(图7)。方解石和白云石单位时间溶出量相同时,K值约为2.0,但反应初期各实验中K值均大于5.0,说明方解石溶出量大于白云石。反应24 h后,各实验中K值趋于稳定,表明方解石和白云石呈等比例溶解。
反应后期超纯水实验(实验A)和添加过硫酸铵的实验(实验B)中,K值基本相同且小于2.0,说明溶液中主要发生白云石溶解。实验B中,反应初期过硫酸铵迅速消耗,后期碳酸盐矿物溶解主要受黄铁矿氧化的影响,因此方解石和白云石溶解比例受过硫酸铵影响有限。但过硫酸铵还原产生的H+导致实验B中的Ca2+浓度高于实验A(图6a),抑制方解石溶解,造成实验B中K值略小于实验A。反应后期添加柠檬酸的实验(实验C和实验D)中,K值基本相同且大于2.0,说明溶液中主要发生方解石溶解。柠檬酸中的羧基可以络合游离的Ca2+[30],降低游离Ca2+浓度,促进方解石溶解,因此添加柠檬酸的实验(实验C和实验D)中K值高于未添加柠檬酸的实验(实验A和实验B)。实验D中,过硫酸铵和柠檬酸同时存在,但K值大于2.0,因此柠檬酸对方解石和白云石溶解比例的影响更持久。
所以,过硫酸铵和柠檬酸均有利于黄铁矿氧化,产生的H+能够促进碳酸盐矿物溶解。过硫酸铵在反应初期迅速消耗,对方解石和白云石溶解比例的影响有限。柠檬酸能够促进方解石溶解,对方解石和白云石溶解比例的影响持久。
-
页岩在反应过程中会释放多种金属元素,元素性质和含量不同导致溶出量有所差别(图8)。As、Sb、Pb等元素的浓度与黄铁矿含量有关[31],过硫酸铵和柠檬酸均有利于黄铁矿氧化,促进金属元素溶出。Mn、Sr等元素主要存在于碳酸盐矿物中[24],黄铁矿氧化产生的H+能够促进碳酸盐溶解,使页岩释放更多的金属元素。V、Cr、Tl等元素主要储存在粘土矿物和有机质中[31],实验D中含有碳酸钾,较多的K+能够抑制粘土矿物吸附金属元素,因此V、Cr、Tl等元素的浓度在实验D中最高。
由式(1)可知,黄铁矿氧化产生的
${\rm{SO}}_4^{2-} $ 是Fe3+的2倍,而不同添加剂实验中Fe3+的最大溶出量为23 μg·L−1,这远小于SO42-的溶出量,说明Fe3+基本全部转化为Fe(OH)3。柠檬酸可以抑制Fe3+沉淀,但Fe3+容易水解,因此柠檬酸的影响是有限的。同样,Al3+也容易水解,在溶液中主要以Al(OH)3的形式存在。Ba2+浓度在实验D中最高,实验A和实验B中基本一致,实验C中最低。实验D中含有过硫酸铵、柠檬酸、乙二醇和碳酸钾,离子强度较高,能够促进Ba2+溶出,阻垢剂乙二醇也可以抑制Ba2+沉淀,且Ba2+溶出受碳酸盐矿物溶解的影响很大,实验D中碳酸盐溶解量最大,因此Ba2+浓度最高。相比于实验A,实验B中碳酸盐溶解量较大,造成Ba2+浓度略高于实验A。实验C中Ba2+浓度最低,这可能是柠檬酸和游离Ba2+络合生成Ba3(C6H5O7)2沉淀导致的。整体上,添加柠檬酸的实验(实验C和实验D)中,大多数金属元素的浓度高于未添加柠檬酸的实验(实验A和实验B)(图8),说明柠檬酸对元素溶出的影响较大。同时,实验D中含有多种添加剂,离子强度较高,也有利于页岩释放金属元素。
研究发现,添加剂主要通过影响黄铁矿氧化和碳酸盐矿物溶解控制金属元素溶出量,元素溶出受柠檬酸的影响较大。同时,添加剂会增加离子强度,促进金属元素溶出。
-
(1)水-页岩反应过程中,酸性环境有利于碳酸盐矿物溶解,溶液pH主要受碳酸盐溶解控制,最终稳定在6.8—9.3。强酸环境中,反应后期容易发生去白云岩化作用,产生含钙沉淀。温度升高(从25 ℃升高到70 ℃)有利于黄铁矿氧化。反应初期CO2是影响Ca2+浓度的主要因素,后期黄铁矿氧化产生的H+能够促进碳酸盐矿物继续溶解。高离子强度环境有利于金属元素(Al除外)溶出,促进Fe(OH)3、BaSO4等难溶化合物及碳酸盐矿物的溶解。高固液比环境有利于碳酸盐矿物溶解和黄铁矿氧化,增加Ba、Sr等微量元素的溶出量。溶液初始pH和离子强度对元素溶出的影响显著,温度和固液比的影响较小。
(2)压裂液中的过硫酸铵和柠檬酸均有利于黄铁矿氧化,不同添加剂实验中
${\rm{SO}}_4^{2-} $ 与Ca2+和Mg2+均呈线性增长(R2均大于0.9),说明黄铁矿氧化产生的H+能够促进碳酸盐矿物溶解。过硫酸铵在反应初期迅速消耗,对方解石和白云石溶解比例的影响有限,而柠檬酸始终产生作用,能够促进方解石溶解,对方解石和白云石溶解比例的影响持久,导致单位时间Ca2+和Mg2+溶出量物质的量之比大于2.0。添加剂主要通过影响黄铁矿氧化和碳酸盐矿物溶解控制金属元素溶出量,柠檬酸对元素溶出的影响程度较高。同时,添加剂会增加离子强度,促进金属元素溶出。
龙马溪组页岩组分在液-岩作用过程中的释放特征
Releasing characteristics of the Longmaxi Formation shale components during fluid-rock interactions
-
摘要: 压裂液-页岩作用存在于整个水力压裂过程中,受页岩组分、储层环境和压裂液成分的共同影响,导致返排液组分十分复杂。探究储层环境中的压裂液-页岩作用机理,对预测返排液组分和防治地下水污染具有重要意义。本文通过室内实验研究了环境因素和压裂液成分对龙马溪组页岩组分在液-岩作用过程中释放特征的影响。结果表明,酸性环境有利于碳酸盐矿物溶解,溶液pH主要受碳酸盐溶解控制,最后保持在6.8—9.3;温度升高(从25 ℃升高到70 ℃)有利于黄铁矿氧化,增加碳酸盐矿物溶解量;高离子强度环境有利于金属元素溶出,促进难溶化合物和碳酸盐矿物的溶解;高固液比环境有利于碳酸盐矿物溶解和黄铁矿氧化,促进微量元素溶出。溶液初始pH和离子强度对元素溶出的影响显著,温度和固液比的影响较小。压裂液中的过硫酸铵和柠檬酸均有利于黄铁矿氧化,产生的H+能够促进碳酸盐矿物溶解。过硫酸铵在反应初期迅速消耗,而柠檬酸始终在促进方解石溶解。添加剂主要通过影响黄铁矿氧化和碳酸盐矿物溶解控制金属元素溶出量,柠檬酸对元素溶出的影响程度较高。同时,添加剂会增加离子强度,促进金属元素溶出。Abstract: Fracturing fluid-shale interactions are involved in the whole process of hydraulic fracturing and affected by shale compositions, reservoir environment and fracturing fluid compositions, resulting in complex components of reverse drainage. Exploring the mechanisms of fracturing fluid-shale interactions in reservoir environment are of great significance for predicting components of reverse drainage and preventing groundwater pollution. In this study, the influence of environmental factors and fracturing fluid compositions on releasing characteristics of the Longmaxi Formation shale components during fluid-rock interactions were studied through laboratory experiments. The results showed that the acidic environment was beneficial to the dissolution of carbonate minerals. The solution pH was mainly controlled by the dissolution of carbonates and finally maintained in the range of 6.8—9.3. The increase of temperature (from 25 ℃ to 70 ℃) enhanced the oxidation of pyrite and increased the dissolved amount of carbonate minerals. The high ionic strength environment was beneficial to the dissolution of metal elements and promoted the dissolution of insoluble compounds and carbonate minerals. The high solid-liquid ratio environment facilitated the dissolution of carbonate minerals and the oxidation of pyrite and enhanced the dissolution of trace elements. The initial pH and the ionic strength of the solution had significant effects on the dissolution of elements, while the temperature and the solid-liquid ratio had a weak effect. Both ammonium persulfate and citric acid in the fracturing fluid were beneficial to the oxidation of pyrite and the H+ produced from the oxidation could intensify the dissolution of carbonate minerals. Ammonium persulfate was consumed rapidly in the initial stage of the reactions while citric acid promoted the dissolution of calcite. Additives controlled the dissolved amount of metal elements mainly by affecting the oxidation of pyrite and the dissolution of carbonate minerals. Citric acid had a higher degree of influence on the dissolution of elements. At the same time, additives increased the ionic strength and consequently enhanced the dissolution of metal elements.
-
Key words:
- shale /
- hydraulic fracturing /
- environmental factor /
- additive /
- fluid-rock interaction
-

-
表 1 龙马溪组页岩主要矿物组分
Table 1. Main minerals of the Longmaxi Formation shale
组分Components 分子式Molecular formula 含量/%wt Content 石英 SiO2 28 钾长石 KAlSi3O8 3.5 钠长石 NaAlSi3O8 7 方解石 CaCO3 17 白云石 CaMg(CO3)2 5 黄铁矿 FeS2 2 伊利石 K0.6Mg0.25Al2.3Si3.5O10(OH)2 19.5 绿泥石 Mg5Al2Si3O10(OH)8 10.3 伊/蒙混层 混层比:10 7.7 表 2 实验中不同环境变量的设置
Table 2. Designed environmental variables in experiments
变量
Variables编号
No.初始pH
Initial pH温度/℃
Temperature离子强度/(mol·L−1)
Ionic strength固液比/(g·L−1)
Solid-liquid ratio初始pH #1—#4 2.0、4.0、7.0和9.0 25±1 超纯水 5 温度 #5—#7 6.2 25±1、50±1和70±1 超纯水 5 离子强度 #8—#10 6.2 25±1 0.09、0.17和0.42 5 固液比 #11—#13 6.2 25±1 超纯水 1、5和10 表 3 实验中的模拟压裂液成分配制
Table 3. Simulated fracturing fluid compositions in experiments
编号No. 模拟压裂液成分Simulated fracturing fluid compositions A(对照组) 超纯水 B 过硫酸铵(0.006%wt)+超纯水 C 柠檬酸(0.004%wt)+超纯水 D 过硫酸铵(0.006%wt)+柠檬酸(0.004%wt)+乙二醇(0.002%wt)+碳酸钾(0.01%wt)+超纯水 -
[1] 张东晓, 杨婷云. 美国页岩气水力压裂开发对环境的影响 [J]. 石油勘探与开发, 2015, 42(6): 801-807. ZHANG D X, YANG T Y. Environmental impacts of hydraulic fracturing in shale gas development in the United States [J]. Petroleum Exploration and Development, 2015, 42(6): 801-807(in Chinese).
[2] 张东晓, 杨婷云. 页岩气开发综述 [J]. 石油学报, 2013, 34(4): 792-801. doi: 10.7623/syxb201304023 ZHANG D X, YANG T Y. An overview of shale gas production [J]. Acta Petrolei Sinica, 2013, 34(4): 792-801(in Chinese). doi: 10.7623/syxb201304023
[3] ZHANG S, SHENG J J. Effect of water imbibition on hydration induced fracture and permeability of shale cores [J]. Journal of Natural Gas Science and Engineering, 2017, 45: 726-737. doi: 10.1016/j.jngse.2017.06.008 [4] PAUKERT VANKEUREN A N, HAKALA J A, JARVIS K, et al. Mineral reactions in shale gas reservoirs: Barite scale formation from reusing produced water as hydraulic fracturing fluid [J]. Environmental Science & Technology, 2017, 51(16): 9391-9402. [5] MAGUIRE-BOYLE S J, BARRON A R. Organic compounds in produced waters from shale gas wells [J]. Environmental Science:Processes & Impacts, 2014, 16(10): 2237-2248. [6] 竹涛, 薛泽宇, 牛文凤, 等. 中美页岩气水力压裂返排液环境影响与治理 [J]. 油气田环境保护, 2019, 29(5): 65-70,78. doi: 10.3969/j.issn.1005-3158.2019.05.018 ZHU T, XUE Z Y, NIU W F, et al. Water quality characteristics and treatment status of hydraulic fracturing effluent during shale gas exploitation in China and the United States [J]. Environmental Protection of Oil & Gas Fields, 2019, 29(5): 65-70,78(in Chinese). doi: 10.3969/j.issn.1005-3158.2019.05.018
[7] 杨德敏, 夏宏, 袁建梅, 等. 页岩气压裂返排废水处理方法探讨 [J]. 环境工程, 2013, 31(6): 31-36. YANG D M, XIA H, YUAN J M, et al. Discussion on treatment methods of fracturing recovery wastewater from shale gas filed [J]. Environmental Engineering, 2013, 31(6): 31-36(in Chinese).
[8] 刘平礼, 兰夕堂, 李年银, 等. 酸预处理在水力压裂中降低伤害机理研究 [J]. 西南石油大学学报(自然科学版), 2016, 38(3): 150-155. LIU P L, LAN X T, LI N Y, et al. A study on damage reduction mechanism of acid preflushing during hydraulic fracturing [J]. Journal of Southwest Petroleum University (Science & Technology Edition), 2016, 38(3): 150-155(in Chinese).
[9] 葛忠伟, 樊莉. 页岩气研究中应注意的问题 [J]. 油气地质与采收率, 2013, 20(6): 19-22. doi: 10.3969/j.issn.1009-9603.2013.06.005 GE Z W, FAN L. Some notable problems about shale gas in the scientific research [J]. Petroleum Geology and Recovery Efficiency, 2013, 20(6): 19-22(in Chinese). doi: 10.3969/j.issn.1009-9603.2013.06.005
[10] WANG L, FORTNER J D, GIAMMAR D E. Impact of water chemistry on element mobilization from Eagle Ford shale [J]. Environmental Engineering Science, 2015, 32(4): 310-320. doi: 10.1089/ees.2014.0342 [11] 周冰, 刘立, 金之钧, 等. 泥岩盖层的溶蚀作用机理实验-不同pH值盐水中溶蚀速率变化规律 [J]. 石油学报, 2017, 38(8): 916-924. doi: 10.7623/syxb201708006 ZHOU B, LIU L, JIN Z J, et al. Dissolution mechanism experiment of mudstone cap: the variation law of dissolution rate in different pH value brine [J]. Acta Petrolei Sinica, 2017, 38(8): 916-924(in Chinese). doi: 10.7623/syxb201708006
[12] 张杰, 寿建峰, 文应初, 等. 去白云石化作用机理及其对储集层的改造 [J]. 古地理学报, 2012, 14(1): 69-84. doi: 10.7605/gdlxb.2012.01.007 ZHANG J, SHOU J F, WEN Y C, et al. Mechanism of dedolomitization and its rebuilding to reservoir [J]. Journal of Palaeogeography, 2012, 14(1): 69-84(in Chinese). doi: 10.7605/gdlxb.2012.01.007
[13] MARCON V, JOSEPH C, CARTER K E, et al. Experimental insights into geochemical changes in hydraulically fractured Marcellus Shale [J]. Applied Geochemistry, 2017, 76: 36-50. doi: 10.1016/j.apgeochem.2016.11.005 [14] DIETERICH M, KUTCHKO B, GOODMAN A. Characterization of marcellus shale and huntersville chert before and after exposure to hydraulic fracturing fluid via feature relocation using field-emission scanning electron microscopy [J]. Fuel, 2016, 182: 227-235. doi: 10.1016/j.fuel.2016.05.061 [15] CRITTENDEN J C, TRUSSELL R R, HAND D W, et al. MWH's water treatment: principles and design[M]. New Jersey: John Wiley & Sons, 2012. [16] 闫志为, 刘辉利, 张志卫. 温度及CO2对方解石, 白云石溶解度影响特征分析 [J]. 中国岩溶, 2009, 28(1): 7-10,41. doi: 10.3969/j.issn.1001-4810.2009.01.002 YAN Z W, LIU H L, ZHANG Z W. Influences of temperature and
${{\rm{P}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}} $ on the solubility of calcite and dolomite [J]. Carsologica Sinica, 2009, 28(1): 7-10,41(in Chinese). doi: 10.3969/j.issn.1001-4810.2009.01.002[17] 李丹, 徐飞高, 赵末名, 等. 不同类型酸对石灰岩的模拟腐蚀实验 [J]. 环境化学, 2011, 30(12): 2069-2074. LI D, XU F G, ZHAO M M, et al. Simulated corrosion by acid rain on carbonate stone [J]. Environmental Chemistry, 2011, 30(12): 2069-2074(in Chinese).
[18] 吴志坚, 刘海宁, 张慧芳. 离子强度对吸附影响机理的研究进展 [J]. 环境化学, 2010, 29(6): 997-1003. WU Z J, LIU H N, ZHANG H F. Research progress on mechanisms about the effect on ionic strength on adsorption [J]. Environmental Chemistry, 2010, 29(6): 997-1003(in Chinese).
[19] 杨亚提, 张平. 离子强度对恒电荷土壤胶体吸附Cu2+和Pb2+的影响 [J]. 环境化学, 2001, 20(6): 566-571. doi: 10.3321/j.issn:0254-6108.2001.06.007 YANG Y T, ZHANG P. Ionic strength effects on Cu2+, Pb2+ adsorption in constant charge soil colloids [J]. Environmental Chemistry, 2001, 20(6): 566-571(in Chinese). doi: 10.3321/j.issn:0254-6108.2001.06.007
[20] RISTHAUS P, BOSBACH D, BECKER U, et al. Barite scale formation and dissolution at high ionic strength studied with atomic force microscopy [J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2001, 191(3): 201-214. [21] RENOCK D, LANDIS J D, SHARMA M. Reductive weathering of black shale and release of barium during hydraulic fracturing [J]. Applied Geochemistry, 2016, 65: 73-86. doi: 10.1016/j.apgeochem.2015.11.001 [22] MOGOLLÓN J L, PÉREZ-DIAZ A, MONACO S L. The effects of ion identity and ionic strength on the dissolution rate of a gibbsitic bauxite [J]. Geochimica et Cosmochimica Acta, 2000, 64(5): 781-795. doi: 10.1016/S0016-7037(99)00351-8 [23] PHAN T T, CAPO R C, STEWART B W, et al. Trace metal distribution and mobility in drill cuttings and produced waters from Marcellus Shale gas extraction: Uranium, arsenic, barium [J]. Applied Geochemistry, 2015, 60: 89-103. doi: 10.1016/j.apgeochem.2015.01.013 [24] WILKE F D H, VIETH-HILLEBRAND A, NAUMANN R, et al. Induced mobility of inorganic and organic solutes from black shales using water extraction: Implications for shale gas exploitation [J]. Applied Geochemistry, 2015, 63: 158-168. doi: 10.1016/j.apgeochem.2015.07.008 [25] LIANG L, HOFMANN A, GU B. Ligand-induced dissolution and release of ferrihydrite colloids [J]. Geochimica et Cosmochimica Acta, 2000, 64(12): 2027-2037. doi: 10.1016/S0016-7037(00)00349-5 [26] PEIFFER S, STUBERT I. The oxidation of pyrite at pH 7 in the presence of reducing and nonreducing Fe (Ⅲ)-chelators [J]. Geochimica et Cosmochimica Acta, 1999, 63(19/20): 3171-3182. [27] GREGORY K B, VIDIC R D, DZOMBAK D A. Water management challenges associated with the production of shale gas by hydraulic fracturing [J]. Elements, 2011, 7(3): 181-186. doi: 10.2113/gselements.7.3.181 [28] WANG L, BURNS S, GIAMMAR D E, et al. Element mobilization from Bakken shales as a function of water chemistry [J]. Chemosphere, 2016, 149: 286-293. doi: 10.1016/j.chemosphere.2016.01.107 [29] LI Y, YANG S, LIU D, et al. Experimental study of shale-fluids interaction during oxidative dissolution with hydrogen peroxide, sodium hypochlorite and sodium persulfate [J]. Applied Geochemistry, 2020, 113: 104503. doi: 10.1016/j.apgeochem.2019.104503 [30] 卜显忠, 高珂, 龙涛. 高钙体系中柠檬酸对磁黄铁矿的活化作用 [J]. 金属矿山, 2017(3): 81-86. doi: 10.3969/j.issn.1001-1250.2017.03.017 BU X Z, GAO K, LONG T. Activation mechanism of pyrrhotite by citric acid in high calcium system [J]. Metal Mine, 2017(3): 81-86(in Chinese). doi: 10.3969/j.issn.1001-1250.2017.03.017
[31] TUTTLE M L W, BREIT G N, GOLDHABER M B. Weathering of the new albany shale, kentucky: Ⅱ. Redistribution of minor and trace elements [J]. Applied Geochemistry, 2009, 24(8): 1565-1578. doi: 10.1016/j.apgeochem.2009.04.034 -



 下载:
下载: