-
环氧树脂双酚A二缩水甘油醚(epoxy bisphenol A diglycidyl ether, BADGE)是由环氧氯丙烷与双酚A(bisphenol A, BPA)在氢氧化钠存在下缩合反应合成的工业化合物[1],其结构如下所示。

BADGE被用于罐头食品和饮料的包装涂层超过半个世纪。在罐装食品中,涂层对于防止食品在生产和贮存过程中腐蚀包装材料以及防止金属迁移至食品中至关重要, BADGE是形成环氧树脂最基本的单体,也用作消除PVC生产中过量盐酸的添加剂[2]。BADGE广泛用于我们的日常生活中,如家具涂料、油漆、牙科密封胶等。2003年,BADGE的全球年产量高达95.7万吨[3]。
2005年,美国国家职业安全与健康研究所将BADGE认定为第三类致癌物和诱变剂,即认为对人类没有致癌性[4]。然而,随着环境流行病学和毒理学的发展,越来越多的研究表明BADGE具有遗传毒性和致癌性。如BADGE能够与DNA形成加合物,还可以通过诱变作用影响细胞基因的表达,并在体外实验中发现其具有致畸作用[5]。据报道,BADGE 及其水解产物对人淋巴细胞微核具有诱导作用,且 BADGE能促进mcf-7乳腺癌细胞的增殖[6]。作为一类增塑剂,BADGE可直接穿过胎盘到达胎儿,并具有破坏胎盘细胞脂质基团的能力等[1]。
BADGE及其衍生物(统称为BADGEs)在环境中广泛存在,如水环境[7-8],室内空气和灰尘[9-11]等。此外,作为涂层成分,BADGEs能够从包装涂层中迁移到食品中,造成食品污染[12-15]。这些污染物通过各种暴露途径进入人体,在人体尿液[3, 16-17]、血浆、血清、卵泡和脂肪[18-19]等组织中频繁检出。因此,明晰BADGEs等在环境介质、食品中的污染状态,了解该类物质的生物学毒性,对评估该类物质对环境和人体健康的影响有重要意义。
-
BADGE是淡黄色油状液体,分子量为340。BADGE水溶性较好(5 mg∙L−1, 25 ℃),同时也具有一定的脂溶性(辛醇-水分配系数为3.7—3.9),因此需要在高温条件下添加固化剂,以获得足够的稳定性。经过与交联剂固化,环氧树脂体系基本上是惰性的,对各种材料具有优异的附着力、耐腐蚀性和耐化学性,以及优良的热绝缘和电绝缘性能等[20]。但是当聚合条件或固化过程不充分时,可能会有部分BADGE处于未反应的状态。BADGE具有反应活性,倾向于从涂层中迁移到食品中,也会在加工和存储过程中发生各种反应:小部分BADGE可能被水解;当环氧涂料与水基或酸性食品接触时,通常会形成BADGE的水合衍生物;此外,大部分的BADGE将与氨基酸,蛋白质,脂质等发生反应[12]。
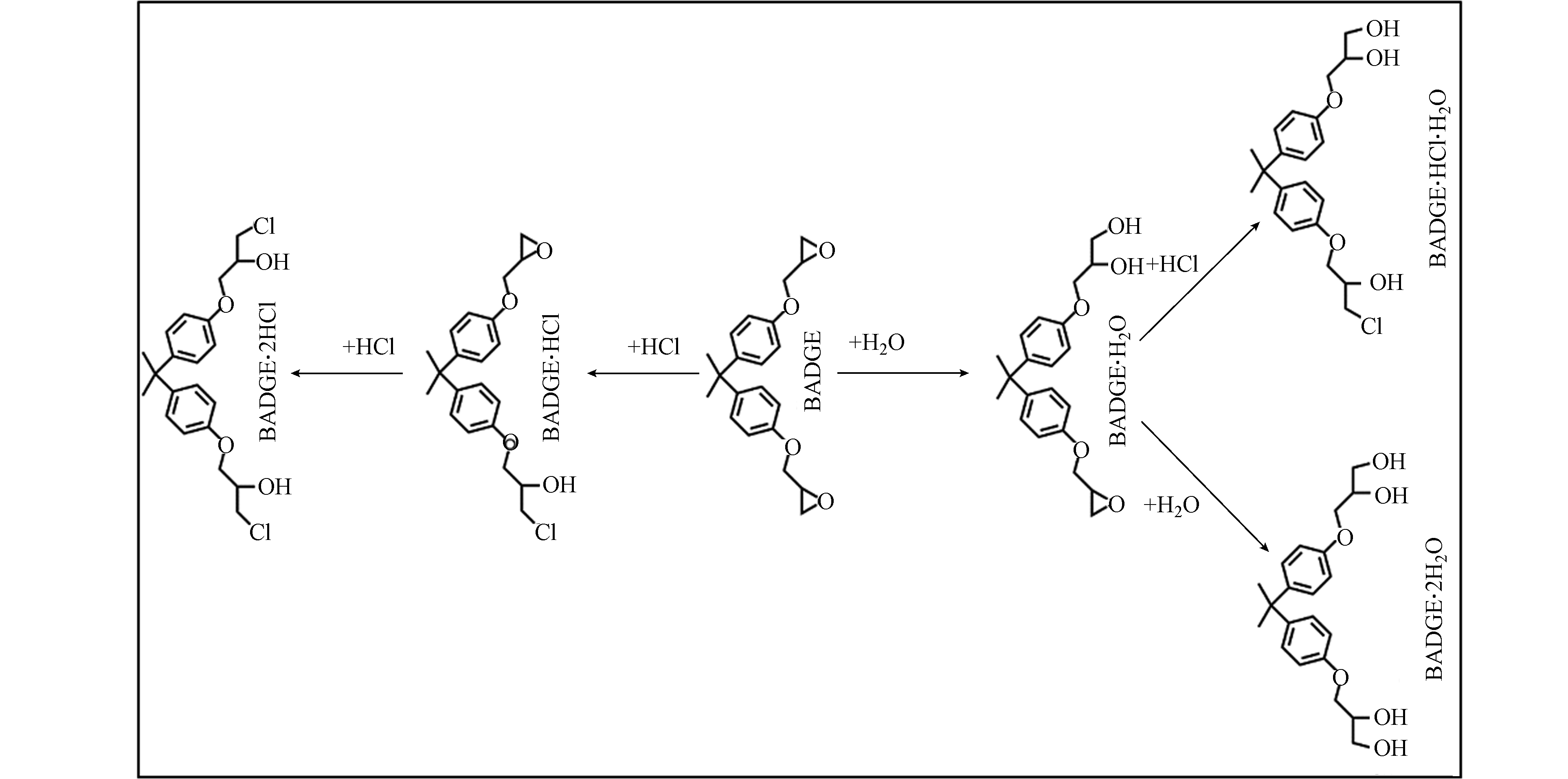
BADGE衍生物主要包括BADGE∙H2O、BADGE∙2H2O、BADGE∙HCl∙H2O、BADGE∙HCl、BADGE∙2HCl等[21]。氯化衍生物BADGE∙HCl和BADGE∙2HCl生成于罐头内衬层热镀过程中,而BADGE·2H2O和BADGE·HCl·H2O是BADGE的稳定水解产物,其中BADGE∙2H2O是主要的水解产物。图1显示了BADGE及其衍生物之间的转化关系。在不同的基质中,BADGEs存在的形式与浓度水平不尽相同[22]。
研究普遍认为,罐头涂层如使用BADGE为单体的环氧树脂涂料会产生双酚A(BPA)[2]。BPA主要用于生产聚碳酸酯塑料、用于金属罐线的环氧树脂,以及许多塑料消费品,包括玩具、水管、饮水容器、眼镜镜片、运动安全设备、牙科单体、医疗设备和管子以及消费电子产品[23]。BPA具有潜在的内分泌干扰性,因而欧盟于2011年开始禁止BPA在婴儿奶瓶的制造和销售中的使用,而法国则禁止在所有食品包装材料中使用BPA。
-
BADGE作为环氧树脂的原料,广泛应用食品包装涂层和牙科涂层等,经人体代谢和地球化学循环,释放到环境介质中。目前,已经在水体(包括水相和颗粒物),空气,粉尘等环境介质中检测到BADGEs的存在。
-
牙科密封胶是BADGEs一个特殊的来源。牙科密封胶可使得牙齿形成易于清洁的光滑表面,在牙科领域广泛用于预防蛀牙。由于儿童蛀牙的概率较大,牙科密封胶在儿童中使用更加普遍。自1988年以来,美国儿童使用牙科密封胶的人数稳步增长。密封胶和复合树脂填充物会发生聚合。然而,研究表明这些聚合物在化学上不稳定,可以释放BADGEs到口腔环境中。Xue等报道了不同国家牙科密封胶中BADGEs的污染水平(表1)[24]。
这项研究包括了来自5个国家的70个树脂基牙科密封胶,每个样本中至少有一种BADGEs被检出。BADGEs的总浓度范围为 <MLOQ-1820 µg∙g−1,其主要的衍生物为BADGE∙2H2O,BADGE∙HCl∙H2O和BADGE∙2HCl(按浓度递减)[24]。观察到BADGE 和其他所有除BADGE·H2O的衍生物浓度之间存在显着的负相关。这表明可能所有 BADGE 衍生物都源自母体化合物 BADGE。不同国家的牙科密封胶BADGEs的浓度水平存在显著差异,美国样品的各类衍生物的浓度水平和检出率都较高。同样地,同一国家不同品牌之间的BADGEs浓度也有很大差异,如列支敦士登两个不同品牌之间的BADGEs的总浓度相差两个数量级。牙科密封剂中BADGEs 的浓度比双酚高2—3个数量级。从牙科密封胶浸出到唾液中可能是人类接触BADGEs的途径[24]。
-
作为环氧树脂的常用原料,BADGE常用于罐头涂层中。但是如果涂料配制不当,该化合物可能会溶出迁移,并造成食品污染。食品包装涂层中的BADGE在加工、存储过程中可以发生各种反应。例如,在弱酸性条件下,如果罐头食物中存在食盐,BADGE可形成盐酸盐化合物;在富含蛋白质和碳水化合物的食品中还观察到BADGE的快速降解[2]。BADGE的迁移、水解和氢氯化衍生物的形成主要发生在灭菌过程中,而BADGE与食品蛋白反应主要发生在加工和存储过程中,前者占BADGE迁移总量的小部分,而后者占据主要部分[12]。这无疑是一个令人担忧的问题,一方面,BADGE与蛋白质加成产物的化学结构、毒性和过敏原潜力尚不清楚;另一方面,相关的法规只考虑BADGE及其水解产物和氯化产物的迁移上限,而忽视了与蛋白质结合进入食物的大部分BADGE [12]。此外,一项模拟研究表明,在使用中性水和NaCl溶液对罐头进行灭菌的过程中,可以生成BADGE∙2H2O和BADGE∙H2O;而在使用含乙酸,盐酸以及氯化钠的酸性溶液进行灭菌时,发现可以产生BADGE∙2H2O和BADGE∙HCl∙H2O [25]。
在罐装食品中,主要存在的是衍生物BADGE∙2H2O和BADGE∙HCl∙H2O,Cao等的研究发现其含量最高分别可达675 μg∙kg−1和274 μg∙kg−1,而BADGE、BADGE∙HCl、BADGE∙2HCl和BADGE∙H2O的含量极低或未检出[26]。与食品相比,罐装饮料中的BADGE迁移量要低得多,这是因为其杀菌条件相对来说比较温和。BADGE∙2H2O通常是罐装饮料中唯一能被检测到的BADGEs [26]。
BADGEs的迁移速率直接影响食品中BADGEs的含量,进而影响人体暴露水平[27]。BADGEs的迁移速率与以下因素密切相关:首先,加工温度。大多数罐头食品需要通过高温消毒,此时部分BADGE会转化为水合衍生物和氯化衍生物,这在一定程度上影响了其迁移速率[27]。其次,储存时间和储存温度。一项对墨西哥罐头涂料中BADGE向食品模拟物中迁移的研究发现,热处理可以提高BADGE的迁移速率。根据罐中食物的不同,迁移率和温度之间的关系不尽相同。此外,BADGE迁移速率还受其在食品模拟物中水解敏感性的影响[28]。需要注意的是,罐中食品的脂肪含量与BADGEs的迁移速率显著相关,脂肪含量越高,迁移速度越快[28]。
-
目前关于室内粉尘中BADGEs的报道有限,但 BADGEs在粉尘中的含量并不低,其浓度水平一般为1.0 µg∙g−1。部分室内粉尘可通过呼吸道,消化道和皮肤进入人体,是人体暴露于BADGEs的潜在来源.
目前,美国和亚洲一些国家报道了室内灰尘样本中BADGEs的污染情况(表2)。在室内粉尘中能检测到的BADGEs包括:BADGE∙H2O、BADGE∙2H2O和BADGE∙HCl∙H2O,其中BADGE∙2H2O和BADGE∙HCl∙H2O是BADGE的稳定水解产物,BADGE∙H2O则由BADGE与大气中的水分反应所形成[11]。如表2所示,不同国家室内灰尘中BADGEs浓度水平存在显著差异。越南样本中BADGEs的总浓度范围为23.0—1750 ng∙g−1,平均浓度为184 ng∙g−1,其均值分别比美国(1350 ng∙g−1)、中国(1410 ng∙g−1)、韩国(2380 ng∙g−1)和日本(2020 ng∙g−1)低了7、8、11、13倍[11]。在美国、中国、韩国和日本中,4种BADGEs的浓度分布情况相似:BADGE∙2H2O是最主要的化合物,占总浓度的44%—80%;其次是BADGE∙HCl∙H2O和BADGE∙H2O,几何平均浓度分别为131—444 ng∙g−1和21.0—80.0 ng∙g−1;母体化合物BADGE的浓度较低,尤其是对于美国(<LOQ—12.0 ng∙g−1)和日本(<LOQ—8.20 ng∙g−1)的粉尘样品。值得注意的是,BADGE的浓度与BADGEs的总浓度之间不存在显著相关性,这可能是与BADGE及其水解产物发生复杂转化反应有关。但是BADGE∙2H2O和BADGE∙HCl∙H2O 的浓度总和与BADGE的浓度呈正相关,表明这些化合物的释放具有同源性[10]。
-
BADGEs经过下水道系统到达污水处理厂。经污水处理厂排出的BADGEs约占其生产量的3.5%,因此污水处理厂排放是这些化合物从水体环境释放到其他环境介质的主要渠道[29]。BADGE及其衍生物在废水体系(废水、颗粒物、污泥)中可被检出。以美国两个污水处理厂为例,与大部分环境介质中类似,BADGE·2H2O是废水中BADGEs的主要成分,两个污水处理厂进水水相中BADGE·2H2O的几何平均浓度分别为6.48 ng·L−1和2.25 ng·L−1,其次为BADGE·H2O,进水中几何平均浓度分别为1.50 ng·L−1和1.94 ng·L−1;而在颗粒物中,BADGE和BADGE·2H2O都是主要成分,其浓度也相近。一般而言,BADGE在水相中的浓度较低,但在颗粒相中其浓度接近BADGE·2H2O,这是因为BADGE倾向吸附于颗粒物。两个污水处理厂进水颗粒物中BADGE的几何平均浓度分别为63.4 ng·g−1和25.6 ng·g−1,BADGE·2H2O的几何平均浓度分别为66.7 ng∙ (g∙dw)−1和36.4 ng∙ (g∙dw)−1;在污泥中,两个污水处理厂BADGE∙2H2O的平均浓度分别为505 ng∙ (g∙dw)−1和388 ng∙ (g∙dw)−1,BADGE的平均几何浓度分别为89.0 ng∙ (g∙dw)−1和41.0 ng∙ (g∙dw)−1 [8]。
美国污水处理厂的研究还发现,经污水处理厂处理后BADGE的去除率分别为18%和 -21%,这表明污水处理厂的工艺对于去除BADGE并不理想,负去除效率则说明了污水处理厂中存在其他前驱物可形成BADGE[8]。分析发现,其中一个污水处理厂污泥中BADGE·HCl和BADGE·2HCl浓度之间存在显著正相关(P < 0.05),这表明,污水处理厂进水中存在的氯离子有利于BADGE∙HCl和BADGE∙2HCl的形成,并最终沉积在污泥中。此外,对比美国两个污水处理厂在工作日和周末之间、夏季和冬季之间,污泥样品中BADGE的浓度均未观察到显著差异[8]。值得注意的是,污泥主要用于土地施肥,这将对土壤造成一定程度的污染。据估算,每年全美污水处理厂排放约2600 kg的BADGEs,其中50%到60%转移至土壤中[29]。
-
如上所述,BADGEs在环境介质、罐装食品和水环境中广泛存在,使得这类污染物有可能进入生物体或人体,在一定条件下对其健康产生威胁。因此需要了解生物体中BADGEs的污染情况。
BADGE在生物基质中的稳定性较差,作为其主要且稳定的代谢产物,BADGE∙H2O和BADGE∙2H2O是指示生物暴露于BADGE的最佳标志物。低温下(-30 ℃),BADGE在血浆和尿液基质能稳定存储5 d[12];而室温条件下存储18 h后,BADGE在血浆基质中的回收率仅为2.4%,在尿液基质中为60.7%。同时,随着BADGE含量的减少,BADGE∙2H2O的含量没有增加,因此无法通过水解产物的形成来解释BADGE的损失。由于BADGE会与食品中的蛋白质发生反应,猜测BADGE的损失可能是因为与基质中的氨基酸和蛋白质发生了反应[12]。在另外一项研究中观察到,BADGE及其水解产物在生物基质中的稳定性为:H2O > 尿液 > 血浆,这也证实了BADGE倾向于与基质中的其他成分发生更复杂的反应。由于反应中心是环氧基团,因而在上述生物基质中,BADGE∙2H2O相对稳定,其次为BADGE∙H2O,而BADGE最不稳定。因此,除了广泛的新陈代谢,体内与氨基酸,肽,蛋白质和其他成分的反应可能是在生物样品中BADGE检出频率较低的重要原因[30]。
-
Bentley等研究了BADGE在动物体内的代谢,发现BADGE可被小鼠体内的环氧化物水解酶迅速水解,且皮肤微粒体活性比在皮肤细胞溶胶中发现的微粒体活性高约10倍[31]。而使用从小鼠,大鼠和兔子获得的肝脏馏分进行体外实验,也可将BADGE的两个环氧基团迅速地水解以形成相应的双二醇,即BADGE∙2H2O。这些实验均未观察到BADGE形成BPA的现象。在人、大鼠和小鼠的肝、肺和皮肤制剂中检查5种不同的缩水甘油醚的代谢,结果也未发现BADGE形成BPA的明显证据[32]。同样地,对小鼠进行口服或经皮给药研究BADGE的代谢,发现小鼠进食BADGE后,BADGE迅速大量排泄,尿液和粪便中鉴定出的代谢产物模式与体外研究结果一致,并证实了BADGE代谢的主要产物是相应的双二醇,该双二醇被进一步偶联或转化为相应的羧酸,且在排泄物中也未检测到BPA。这些体内外研究说明BADGE无法在生物体代谢过程中转化为BPA[33]。
-
BADGEs可被生物吸收。近期一项研究在美国沿海水域的海洋哺乳动物体内发现了BADGEs的踪迹。Xue等人以从美国佛罗里达州,加利福尼亚州,华盛顿州和阿拉斯加沿海水域采集的8种海洋哺乳动物(北极熊、宽吻海豚、斑纹海豚、糙齿海豚、白鳍豚、小抹香鲸、南方海獭和北方海獭)为对象,检测了包括肝脏,肾脏,脂肪和大脑在内的121个组织样品。结果显示,在10个北极熊肝脏样品中有9个检测到BADGE∙2HCl,平均浓度为(162 ± 124) ng∙g−1。在20个鲸类动物肝脏样品中,其中16个发现了BADGE∙2HCl。该物质在雄宽吻海豚、雌宽吻海豚、斑纹海豚、糙齿海豚、白鳍豚、小抹香鲸的肝脏中平均浓度分别为(275 ± 284)ng∙g−1、(388 ± 361) ng∙g−1、(467 ± 151) ng∙g−1、(286 ± 165) ng∙g−1、(956 ± 450) ng∙g−1及(91.7 ± 110 )ng∙g−1。具有年龄数据的样品中没有发现BADGE∙2HCl的浓度与动物年龄存在相关性[34]。该研究在动物脑中发现BADGE∙2HCl,平均浓度为364—264 ng∙g−1,表明这种化合物通过了血脑屏障。
海洋哺乳动物含有BADGEs的原因可能是包括船舶和建筑油漆在内的多种海洋设施都使用BADGE作为涂层材料。据估计,2004年全球消耗的环氧树脂中,约有8.4% 用于海上建筑。而与在其他介质中不同,在海洋生物中BADGE∙2HCl的浓度较高,这可能是因为反应性的环氧基氯离子存在于海水中,氯化物与环氧基团的反应速度比与水的反应速度快。BADGE∙2HCl优先在肝脏中积累,一般在肝脏中含量最高,但是在脑和肾脏中也存在相当高的浓度。该研究在沿海和边远海域的海洋哺乳动物中均发现BADGE∙2HCl,表明BADGEs在海洋环境中的分布广泛[34]。
-
BADGEs进入人体后,可以进行一系列代谢转化、再分布。目前,在人体尿液,血液以及脂肪样本中均发现了BADGEs的存在。
尿液是测试人体BADGEs暴露最常用的基质,美国、中国、希腊、印度等国家都报道了BADGEs在人体尿液中的浓度水平(表3)。从表3可以看出,尿液中BADGE·2H2O为主要物质。除从食物中直接摄入BADGE∙2H2O外,BADGE和其他前体物质在人体内的代谢也可以促进BADGE∙2H2O 的形成。该物质在希腊、中国(2010)、中国(2012)、美国、印度样本中几何平均浓度分别为0.700、0.515、0.502、0.601、12.2 ng∙mL−1 [17]。美国人群尿液中BADGEs总浓度的几何平均值3.00 ng∙mL−1,是中国成人(1.33 ng∙mL−1)和儿童(1.07 ng∙mL−1)的平均浓度的2—3倍;而希腊尿液样品BADGEs的总浓度的几何平均浓度为0.9 ng∙mL−1,与中国相仿。
此外,Xue等分析了不同人群尿液中BADGEs的分布,发现孕妇尿液中BADGE占总BADGEs的比重高于男性。同时,从含量上看,经肌酐调节后的BADGE浓度水平女性高于男性,这种现象在女童和男童身上也得到了验证。这种性别差异可能是由男性和女性对BADGEs不同的代谢途径引起的[16]。
血浆和脂肪中BADGEs的报道相对较少,但BADGE及其5种衍生物均可被检出(表3)。脂肪样本中,BADGE∙2H2O的检出率为60%,最大浓度为45.4 ng∙g−1(湿重);BADGE的检出率为25%,最大浓度为5.16 ng∙g−1;而BADGE的氯醇衍生物,包括BADGE∙H2O∙HCl,BADGE∙HCl和BADGE∙2HCl只在极少数样本中检出(<20%)。此外,在所分析的70%的血浆样品中至少发现了6种BADGE中的一种,而这6种BADGEs的浓度总和范围为0.78—64.6 ng∙g−1,中位数浓度值为4.80 ng∙g−1。BADGE的水合衍生物的检出率约为65%,BADGE·2H2O的中位数浓度为7.15 ng∙mL−1,是BADGE·H2O中位数浓度(2.26 ng∙mL−1)的3倍。
环氧树脂是石油化工厂的常见原料,在制造生产过程中极有可能出现BADGE。一项研究测定了韩国石油化工厂工人和非石油化工厂工人血清中BADGE的暴露水平(表3)。比较两组人群血清之间的浓度可以发现,非石油化工厂工人血清的BADGE和BADGE∙2H2O浓度相对高于石化厂工人[19]。
-
物质的结构决定物理化学性质。环氧化合物的毒性强度主要取决于未反应的环氧基的浓度。单体BADGE在其结构中存在两个环氧基,而BADGE∙H2O和BADGE∙2H2O仅存在一个环氧基,因而理论上BADGE的毒性作用要强于BADGE∙H2O和BADGE∙2H2O。BADGE∙2HCl的情况有所不同,该化合物虽然不具有任何环氧基,但其毒性与BADGE∙H2O相当,这可能是由于氯基的存在[35]。
-
BADGE暴露可降低胞质分裂阻滞增殖指数。Ramilo 等以人体双核细胞为研究对象,将其暴露于BADGE中,该研究表明当BADGE浓度增加时,胞质分裂阻滞增殖指数显著降低[36]。同样的,在人体的外周血淋巴细胞的微核试验中,使用能产生细胞毒性效应剂量的BADGE染毒,也发现胞质分裂阻滞增殖指数随BADGE剂量增加而下降[35]。
BADGE暴露对细胞增殖的作用不一致。例如:BADGE会导致MCF-7乳腺癌细胞增殖,并导致肿瘤细胞死亡或凋亡,而BADGE在人结肠直肠腺癌Caco-2细胞中会减少细胞增殖并诱导形态变化以及发生细胞脱离[37-38]。
BADGE暴露具有致突变性。Hemminki等通过伤寒沙门氏菌、大肠杆菌和酵母菌等评估了BADGE的致突变性。发现BADGE在原核生物中具有致突变性,但无论酵母菌(真核生物)是否具有代谢活性,BADGE都不会对其产生致突变性[39-40]。当将BADGE应用于大鼠肝细胞时,发现它会增加细胞姐妹染色单体交换和染色单体间隙的百分比[41]。在一项针对果蝇的研究中发现,果蝇在整个发育过程中长期暴露于BADGE会导致基因的转录数量发生重大变化。在含BADGE的食物上饲养的幼虫,血细胞数量显着增加,但造血组织没有明显的物理病变[42]。此外,BADGEs可以通过多种途径诱导大肠杆菌A-T碱基对的取代,其中,BADGE∙H2O的诱变作用比BADGE弱,BADGE∙2H2O和BADGE∙2HCl则没有诱变活性[41]。
BADGE暴露可能是肥胖的一个因素。早期研究表明BADGE是过氧化物酶体增殖物活化受体(PPARγ)的抑制剂,而PPARγ是脂肪细胞基因表达和分化的主要协调者,即BADGE会抑制脂肪细胞的生成[43]。但是近期研究发现BADGE可以通过一种高效、选择性的且PPARγ拮抗剂不能抑制的机制,诱导骨髓间充质干细胞和前脂肪细胞的脂肪生成[44]。在体外试验中也发现,BADGE会促进人和小鼠骨髓间充质干细胞向脂肪细胞分化,但是尽管如此,BADGE在生物体内的浓度较低,尚不足以引起发胖[44]。
-
Hutler等首次在动物胚胎(鞭毛虫)研究中发现了BADGE的致死和亚致死作用,在336 h连续暴露生物测定中,早期发育的囊胚是对BADGE最敏感的阶段,其急性毒性最高。在慢性毒性期,只有暴露于BADGE浓度低于0.5 mg∙L−1的鞭毛虫胚胎才能存活,但是存活的胚胎会发生形态学改变。BADGE 对幼虫的毒性显着低于对胚胎的毒性,当暴露于10 mg∙L−1浓度的BADGE时,幼虫在数小时后表现出神经学变化,但在336 h连续测定过程中不会死亡,而所有暴露于15 mg∙L−1BADGE 的幼虫在暴露几小时后都会出现麻醉,然后死亡[6]。BADGE对胚胎和幼虫致畸能力的差异与发育阶段的形态发生变化的速率降低有关[45],胚胎的亚致死效应主要表现为细胞分裂和发育迟缓,而幼虫的亚致死效应主要与神经毒性有关,主要表现为对刺激的恐惧反应和麻醉效应[6]。
高剂量BADGE暴露可导致大鼠死亡。在一项对孕鼠的研究中,以0、375、1500、3000 mg∙(kg∙d)−1浓度BADGE与玉米油充分混合后饲养孕鼠。21 d后,3000 mg∙(kg∙d)−1高剂量暴露实验组所有大鼠死亡,1500 mg∙(kg∙d)−1中等剂量暴露实验组70%大鼠死亡,而 375 mg∙(kg∙d)−1低剂量暴露验组与对照组中,大鼠未发现明显的器官和组织学毒理变化[4]。在另一项为期3个月的亚慢性饮食研究中,雄性大鼠的BADGE饮食暴露浓度分别为0、150、450、1500、4500 mg∙(kg∙d)−1。服用最高剂量水平的大鼠(即4500 mg∙(kg∙d)−1)出现绝食行为,并在饲养20周时全部死亡,但肉眼和组织病理学检查未发现毒性表征。解剖死鼠后发现,这些大鼠表现出营养不良的现象,肝脏和肾脏的重量略有增加。除了增加肾脏重量之外,150 mg∙(kg∙d)−1和450 mg∙(kg∙d)−1实验组的大鼠中未显示出与对照组的显著差异[21]。一项对怀孕大鼠的研究中,发现低剂量地服用BADGE会产生一些轻微的母体毒性,如服用BADGE浓度为500 mg∙kg−1的大鼠会产生流涎现象,且孕鼠每日进食略有减少[21]。
除了口服暴露外,Breslin等通过皮肤接触途径使用新西兰白兔进行BADGE毒性研究:每天以0、100、300、500 mg∙kg−1的剂量将纯度为99.3%的BADGE施用于孕兔的皮肤上。结果表明,在任何测试剂量下,在孕兔中均未观察到对胚胎的毒性作用。但是,在300 mg∙kg−1和500 mg∙(kg∙d)−1剂量组的处理中,孕兔产生了皮肤刺激性毒性,表现出剂量相关的红斑增加,皮肤开裂,开放性伤口和水肿等现象[46]。在随后的确定性发展研究中,检查妊娠28 d后的胎兔的外部、内脏和骨骼变化,与对照组相比,在任何实验组中均未观察到胎鼠畸形或变异的统计学显著增加[47],即未观察到BADGE的发育毒性。
-
尽管BADGE的雌激素活性比BPA低约100倍,但Lyons的报告表明BADGE∙2HCl和BADGE∙2H2O的雌激素活性比BPA的雌激素活性还高[47。Nakazawa等用人体乳腺癌细胞进行雌激素受体竞争结合实验研究了BADGE∙2HCl和BADGE∙2H2O的雌激素活性,结果也证实了其雌激素活性高于BPA,这意味着BADGEs的雌激素活性影响不能被忽视,且有必要研究这些BADGEs对生殖功能是否有害[45]。许多研究证实了BADGEs的雌激素活性导致的生殖毒性。例如,进食BADGE会导致大鼠精子数量减少,生理断精和精子活力下降,甚至导致雄鼠不育[21]。此外,还发现了BADGE会破坏雄性睾丸的发育,在一项对雄性大鼠的睾丸大研究中,以浓度为500、750、1000、2000 mg∙kg−1的BADGE喂食大鼠,结果表明750 、1000 、2000 mg∙kg−1实验组的雄性大鼠,睾丸上未成熟精子的占比明显增加[48]。另一项对人体的研究也发现暴露于BADGEs的男性工人的卵泡刺激素水平低于非暴露人群,而卵泡刺激素的降低会影响精子的形成[49]。
-
BADGE遍布于各种环境介质中,表明人们每天都在接触BADGEs。BADGEs可以通过摄入(食物或粉尘),吸入(空气或颗粒)和皮肤吸收(粉尘)等途径进入人体。可以直接通过潜在环境来源的BADGEs含量计算或从人尿中的BADGEs来估算BADGEs的每日摄入量(DI)。DI的计算如公式1所示:
式中,C为尿液中BADGE的浓度水平(ng·L−1),V为每日排出尿液总量(L),M为人体体重(kg)。该计算方法假设所有摄入的BADGE都经过尿液排出,而实际只有游离BADGE可通过尿液100%排出体外,而共轭BADGE将留在体内。因此此种计算摄入量的方法有一定误差。为了更精确地评估摄入量Wang等[3]提出有效日摄入量EDI(公式2),其中,f为BADGE的分布系数,p为BADGE的组成系数。
表4列出了部分国家居民对BADGEs的每日暴露量及可能来源。由表4可见,人体通过粉尘摄入BADGEs的剂量随年龄的增长而降低,儿童通过灰尘每日摄入的BADGEs比成人摄入的剂量高2.7倍。对人体摄入BADGEs贡献最大的是罐头食品。根据美国罐头食品中BADGEs的浓度水平推算EDI为590 ng∙(kg∙Bw∙d)−1。美国、中国、希腊成年人BADGEs的EDI分别为690、280、410 ng∙(kg∙Bw∙d)−1[17]。表中来源于食品罐头的EDI大于总EDI,这可能是由不同的样本以及不同的推算方法导致的。各种潜在来源中,通过衣物每日被人体吸收的BADGEs剂量很低[50]。牙科密封胶使用人数虽然有限,不属于常规暴露,但是通过牙科密封胶进入人体中的BADGEs与通过罐头食品摄入的剂量处于同一数量级,比通过粉尘摄入的剂量高两个数量级,比通过衣物进入人体的剂量高4个数量级,且牙科密封胶在儿童中的使用量较大。对比表中各个国家之间的EDIs发现,不同国家人群的BADGEs摄入水平相差不大,基本处于同一数量级,且EDIs远低于欧洲食品安全局于2004年规定的每日最大摄入量10 mg∙(kg∙Bw∙d)−1。但是应该注意的是,这个数据是根据尿液中BADGEs的浓度估算的暴露剂量,而未考虑到排便。因此,这个数据可能低于实际暴露剂量。
-
作为广泛应用的涂料,BADGEs已经在各种环境介质以及生物体中被广泛检出。罐头食品、室内粉尘和牙科密封胶等是人体暴露于BADGEs的潜在来源,其中罐头食品的摄入是主要来源。BADGEs在各个基质中的分布与转化不同,例如不是所有的基质都能检测到BADGE及其衍生物。上个世纪针对BADGEs对人体健康影响做了许多的研究:基于现有的毒理学数据和消费者的低暴露水平,2002年,欧洲委员会得出结论,BADGE不会对人体生殖或发育产生毒性作用;欧洲食品安全局在2004年报告表明,BADGEs无内分泌毒性,且对人的胚胎和胎儿发育没有致畸作用或不利影响;2005年美国国家职业安全与健康研究所将BADGE认定为第三类致癌物和诱变剂,即对人体无致癌性。但相关研究表明BADGEs仍具有一定的细胞毒性和生殖毒性,且广泛存在于环境中,BADGEs的雌激素作用以及对细胞增殖的影响引起了学者的关注。2012年首次在人体尿液中发现了BADGEs的存在,2016年首次发现了BADGEs对动物胚胎的致死作用,虽然目前没有直接的证据表明BADGEs对人体的健康危害,但仍应对其引起重视。鉴于BADGEs的潜在毒性,并主要通过食品罐头进入人体,建议孕妇以及婴幼儿尽量少食用罐头食品。目前,由于BADGEs在环境介质中的报道相对较少,应进一步研究BADGEs在环境中的迁移转化及其相关机理;此外,由于BADGE与蛋白质加成产物的化学结构、毒性和过敏原潜力尚不清楚,应进一步研究BADGE与蛋白质的加成机理,避免因忽略与蛋白质的作用产物而低估BADGE的毒性作用。
双酚A二缩水甘油醚的环境分布与毒性特征
Environmental distribution and toxicity characteristics of bisphenol A diglycidyl ether
-
摘要: 环氧树脂单体双酚A二缩水甘油醚(epoxy bisphenol A diglycidyl ether, BADGE)是一些食品接触材料中聚合物的单体,主要用于食品罐头等容器的涂层中,也可用于有机溶胶类容器的涂层。BADGE可从涂层中迁移,并发生水解等化学反应生成以BADGE∙2H2O、BADGE∙H2O为主的几种衍生物BADGEs。目前,废水处理厂水体(水相和颗粒物)、室内空气、灰尘等环境介质中都发现了BADGEs的踪迹,尤其是牙齿密封胶中其浓度水平较高。此外,在实验室模式生物、海洋哺乳动物以及人体血液、尿液、脂肪中均能够检出BADGEs,表明其可被生物体吸收。相关毒性实验表明,与内分泌干扰物双酚A类似,BADGEs具有一定的内分泌干扰性、细胞毒性、生殖发育毒性等。人体对BDAGE暴露的情况可通过监测其尿液中BADGEs的浓度水平体来体现。从现有数据看,人体对BADGEs的暴露水平不高,每日有效摄入量低于欧洲食品安全局于2004年规定的每日最大摄入量10 mg∙(kg∙Bw∙d)−1,其暴露主要来源于罐装食品。BADGEs属于增塑剂,可能会通过胎盘屏障,考虑到其毒性特征,建议孕妇少食罐装和袋装食品,以减少相关暴露。此外,需进一步研究BADGEs生物毒性和相关作用机理。Abstract: Epoxy bisphenol A diglycidyl ether (BADGE) is a polymer monomer in some food packaging materials, mainly used in the coating of food cans, as well as the coating of organosol containers. BADGE can migrate from the coating and undergo chemical reactions such as hydrolysis to generate several derivatives (defined as BADGEs), which are mainly BADGE∙2H2O and BADGE∙H2O. By far, BADGEs were found in various environmental mediums, such as wastewater (both water phase and particles), indoor air and indoor dust, especially with high concentration levels in dental sealant. Besides, BADGEs were also detected in model animals in the labs, sea mammals, and human body (urine, blood and lipid), which indicated they could be accumulated by biota. The results of toxic experiments demonstrated that similar to bisphenol A, BADGEs have cytotoxic, reproductive and development toxicities, and the potential to disrupt endocrine system. Urinary BADGEs were usually determined to monitor human exposure. The available data showed human were exposed to BADGEs at a relative low level, and the daily intakes were lower than the maximum value of 10 mg∙(kg∙Bw∙d)−1 suggested by the European Food Safety Agency in 2004. Canned foods are the main exposure source. BADGEs are plasticizers and may pass through the placental barrier. Considering their toxicity characteristics, we suggest pregnant women should eat less canned and bagged foods to reduce related exposure. Besides, we call for more researches on the biological toxicity of BADGEs and related mechanisms.
-

-
表 1 不同国家牙科密封胶中BADGEs的几何平均浓度(µg∙g-1)
Table 1. Geometric mean concentration (µg∙g-1) of bisphenol A diglycidyl ether and its derivatives (BADGEs) in dental sealants from different countries
国家
Countryn BADGE BADGE·2H2O BADGE·H2O BADGE·HCl BADGE·2HCl BADGE·HCl·H2O BADGEs 美国 51 0.30 12.5 1.36 0.30 2.10 1.96 50.2 韩国 10 0.29 15.9 2.28 1.24 3.99 12.0 54.3 希腊 4 n.d. 31.1 n.d. n.d. n.d. 8.15 41.5 列支敦士登 1 n.d. 6.29 n.d. n.d. n.d. 2.46 10.7 列支敦士登 1 n.d. 1780 n.d. n.d. 3.67 35.2 1820 日本 1 n.d. 1.45 n.d. n.d. n.d. n.d. 3.64 注: n.d.表示样品的平均浓度低于检出限(MLOQ)或定量限(LOQ); BADGE·2H2O、BADGE·H2O、BADGE、BADGE·HCl·H2O、BADGE·HCl和BADGE·2HCl的检出限分别为 1.31、2.19、0.44、0.44、0.44、 0.88 µg∙g−1.
Note: n.d. means the average concentration of the sample is lower than the limit of detection (MLOQ) or limit of quantification (LOQ); The limits of detection of BADGE·2H2O, BADGE·H2O, BADGE, BADGE·HCl·H2O, BADGE·HCl and BADGE·2HCl are 1.31, 2.19, 0.44, 0.44, 0.44, 0.88 µg∙g−1, respectively.表 2 不同国家室内粉尘中BADGEs的浓度 (ng·g-1) 以及检出率 (100%)
Table 2. Concentration (ng·g-1) and detection rate (%) of bisphenol A diglycidyl ether and its derivatives (BADGEs) in indoor dust from different countries
国家(年份)
Country (year)样品数
Sample number地点
LocationBADGE BADGE∙2H2O BADGE∙H2O BADGE·HCl·H2O BADGEs 文献
Reference美国(2006,2010) 40 1.30(77.5) 1060(100) 21.0(100) 132(100) 1300 [10] 美国(2014) 3 停车场 1080(33.0) [9] 4 汽车修理厂 2940(75.0) 7 车内 3680(42.9) 5 理发店 1000(20.0) 13 公共场所 7770(69.2) 26 住宅 4760(65.4) 12 实验室 3540(66.7) 13 办公室 7460(61.5) 中国(2010) 55 5.60(100) 997(100) 67.0(100) 131(100) 1380 [10] 韩国(2012) 41 13.0(100) 2300(100) 80.0(100) 352(100) 2890 [10] 日本(2012) 22 1.54(77.3) 1990(100) 24.0(95.5) 444(100) 2760 [10] 越南(2014) 16 住宅 9.00(68.8) 243(100) 27.4(100) 44.2(100) 324 [11] 18 商店超市 35.1(72.2) 343(100) 74.3(100) 39.6(94.4) 491 7 化验室 32.5(100) 226(100) 67.7(100) 38.9(100) 365 5 办公室 12.5(80.0) 168(100) 29.9(100) 8.21(100) 219 表 3 人体基质中BADGEs的浓度 (ng∙mL-1) 以及检出率(%)
Table 3. The concentration (ng∙mL-1) and detection rate (%) of BADGEs in human matrix
基质
Matrix国家(年份)
Country yearBADGE BADGE·2H2O BADGE·H2O BADGE·HCl BADGE·2HCl BADGE·HCl·H2O 文献
References尿液 中国
(2010)0.0930
(100)0.515
(96.2)0.0760
(92.3)0.0350
(53.8)[3] 中国
(2012)0.139 0.502 0.0460 0.0420 [3] 美国
(2011)0.121
(100)0.601
(100)0.0650
(93.5)0.0520
(63.5)[3] 希腊
(2012)n.d. 0.700
(90.0)n.d.
(9)n.d.
(19.0)[17] 印度
(2012)24.8
(99.0)12.2
(78.0)[17] 脂肪 美国
(2002)n.d.
(25.0)3.44
(60.0)n.d.
(15.0)n.d.
(5.00)n.d.
(5.00)n.d.
(20.0)[18] 血浆 美国
(2003)n.d. 7.15
(70.0)2.26
(65.0)n.d. n.d. n.d. [18] 血清1 韩国 0.628 0.439 [19] 血清2 韩国 0.457 0.154 [19] 注:目标物在尿液的浓度为几何平均浓度,在脂肪和血浆的浓度为中位数浓度;血清1为非石油化工厂工人样本,血清2为石油化工厂工人样本;
Note: The concentration in urine is the geometric mean concentration, and the concentration in fat and plasma is the median concentration; Serum 1 is a sample of non-petrochemical factory workers, and serum 2 is a sample of petrochemical factory workers;表 4 不同国家居民对BADGEs的每日暴露剂量(ng·(kg·bw·d)−1)
Table 4. Estimated daily exposure doses of BADGEs based on potential sources in different countries(ng·(kg·bw·d)−1)
-
[1] MARQUEÑO A, PÉREZ-ALBALADEJO E, FLORES C, et al. Toxic effects of bisphenol A diglycidyl ether and derivatives in human placental cells [J]. Environmental Pollution, 2019, 244: 513-521. doi: 10.1016/j.envpol.2018.10.045 [2] LINTSCHINGER J, RAUTER W. Simultaneous determination of bisphenol A-diglycidyl ether, bisphenol F-diglycidyl ether and their hydrolysis and chlorohydroxy derivatives in canned foods [J]. European Food Research and Technology, 2000, 211(3): 211-217. doi: 10.1007/s002170050026 [3] WANG L, WU Y H, ZHANG W, et al. Widespread occurrence and distribution of bisphenol A diglycidyl ether (BADGE) and its derivatives in human urine from the United States and China [J]. Environmental Science & Technology, 2012, 46(23): 12968-12976. [4] HYOUNG U J, YANG Y J, KWON S K, et al. Developmental toxicity by exposure to bisphenol A diglycidyl ether during gestation and lactation period in sprague-dawley male rats [J]. Journal of Preventive Medicine and Public Health, 2007, 40(2): 155. doi: 10.3961/jpmph.2007.40.2.155 [5] KWON S K, YANG Y J, CHUN Y J, et al. Decreased of clusterin mRNA expression of epididymis following exposure to bisphenol A diglycidyl ether during gestation and lactation in Sprague-Dawley rats [J]. Environmental Health and Toxicology 2008, 23(4): 291-299. [6] HUTLER WOLKOWICZ I, SVARTZ G V, ARONZON C M, et al. Developmental toxicity of bisphenol A diglycidyl ether (epoxide resin badge) during the early life cycle of a native amphibian species [J]. Environmental Toxicology and Chemistry, 2016, 35(12): 3031-3038. doi: 10.1002/etc.3491 [7] BALLESTEROS-GÓMEZ A, RUIZ F J, RUBIO S, et al. Determination of bisphenols A and F and their diglycidyl ethers in wastewater and river water by coacervative extraction and liquid chromatography-fluorimetry [J]. Analytica Chimica Acta, 2007, 603(1): 51-59. doi: 10.1016/j.aca.2007.09.048 [8] XUE J C, KANNAN K. Mass flows and removal of eight bisphenol analogs, bisphenol A diglycidyl ether and its derivatives in two wastewater treatment plants in New York State, USA [J]. Science of the Total Environment, 2019, 648: 442-449. doi: 10.1016/j.scitotenv.2018.08.047 [9] XUE J C, WAN Y J, KANNAN K. Occurrence of bisphenols, bisphenol A diglycidyl ethers (BADGEs), and novolac glycidyl ethers (NOGEs) in indoor air from Albany, New York, USA, and its implications for inhalation exposure [J]. Chemosphere, 2016, 151: 1-8. doi: 10.1016/j.chemosphere.2016.02.038 [10] WANG L, LIAO C Y, LIU F, et al. Occurrence and human exposure of p-hydroxybenzoic acid esters (parabens), bisphenol A diglycidyl ether (BADGE), and their hydrolysis products in indoor dust from the United States and three East Asian countries [J]. Environmental Science & Technology, 2012, 46(21): 11584-11593. [11] TRAN T M, MINH T B, KUMOSANI T A, et al. Occurrence of phthalate diesters (phthalates), p-hydroxybenzoic acid esters (parabens), bisphenol A diglycidyl ether (BADGE) and their derivatives in indoor dust from Vietnam: Implications for exposure [J]. Chemosphere, 2016, 144: 1553-1559. doi: 10.1016/j.chemosphere.2015.10.028 [12] PETERSEN H, BIEREICHEL A, BURSEG K, et al. Bisphenol A diglycidyl ether (BADGE) migrating from packaging material ‘disappears’ in food: Reaction with food components [J]. Food Additives & Contaminants. Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2008, 25(7): 911-920. [13] CIRILLO T, ESPOSITO F, FASANO E, et al. BPA, BPB, BPF, BADGE and BFDGE in canned beers from the Italian market [J]. Food Additives & Contaminants:Part B, 2019, 12(4): 268-274. [14] YONEKUBO J, HAYAKAWA K, SAJIKI J. Concentrations of bisphenol A, bisphenol A diglycidyl ether, and their derivatives in canned foods in Japanese markets [J]. Journal of Agricultural and Food Chemistry, 2008, 56(6): 2041-2047. doi: 10.1021/jf073106n [15] CABADO A G, ALDEA S, PORRO C, et al. Migration of BADGE (bisphenol A diglycidyl-ether) and BFDGE (bisphenol F diglycidyl-ether) in canned seafood [J]. Food and Chemical Toxicology, 2008, 46(5): 1674-1680. doi: 10.1016/j.fct.2008.01.006 [16] XUE J C, WU Q, SAKTHIVEL S, et al. Urinary levels of endocrine-disrupting chemicals, including bisphenols, bisphenol A diglycidyl ethers, benzophenones, parabens, and triclosan in obese and non-obese Indian children [J]. Environmental Research, 2015, 137: 120-128. doi: 10.1016/j.envres.2014.12.007 [17] ASIMAKOPOULOS A G, THOMAIDIS N S, KANNAN K. Widespread occurrence of bisphenol A diglycidyl ethers, p-hydroxybenzoic acid esters (parabens), benzophenone type-UV filters, triclosan, and triclocarban in human urine from Athens, Greece [J]. Science of the Total Environment, 2014, 470/471: 1243-1249. doi: 10.1016/j.scitotenv.2013.10.089 [18] WANG L, XUE J C, KANNAN K. Widespread occurrence and accumulation of bisphenol A diglycidyl ether (BADGE), bisphenol F diglycidyl ether (BFDGE) and their derivatives in human blood and adipose fat [J]. Environmental Science & Technology, 2015, 49(5): 3150-3157. [19] KIM S I, YANG Y J, HONG Y P, et al. Distribution of serum bisphenol A diglycidyl ether and its metabolite in Korean adult men and its association with reproductive hormone levels [J]. Molecular & Cellular Toxicology, 2015, 11(1): 71-78. [20] BELLO A, XUE Y L, BELLO D. Urinary biomonitoring of occupational exposures to Bisphenol A Diglycidyl Ether (BADGE) - based epoxy resins among construction painters in metal structure coating [J]. Environment International, 2021, 156: 106632. doi: 10.1016/j.envint.2021.106632 [21] POOLE A, van HERWIJNEN P, WEIDELI H, et al. Review of the toxicology, human exposure and safety assessment for bisphenol A diglycidylether (BADGE) [J]. Food Additives & Contaminants, 2004, 21(9): 905-919. [22] HEMMINKI K. Binding of styrene oxide to amino acids, human serum proteins and hemoglobin[C]//Toxic Interfaces of Neurones, Smoke and Genes, 1986. [23] VANDENBERG L N, HAUSER R, MARCUS M, et al. Human exposure to bisphenol A (BPA) [J]. Reproductive Toxicology, 2007, 24(2): 139-177. doi: 10.1016/j.reprotox.2007.07.010 [24] XUE J C, KANNAN P, KUMOSANI T A, et al. Resin-based dental sealants as a source of human exposure to bisphenol analogues, bisphenol A diglycidyl ether, and its derivatives [J]. Environmental Research, 2018, 162: 35-40. doi: 10.1016/j.envres.2017.12.011 [25] ZHANG J, LV C, LI Z L, et al. Interactions of bisphenol diglycidyl ethers with estrogen receptors α: Fluorescence polarization, reporter gene, and molecular modeling investigations [J]. Toxicology Letters, 2020, 332: 14-19. doi: 10.1016/j.toxlet.2020.06.023 [26] CAO X L, DUFRESNE G, CLEMENT G, et al. Levels of bisphenol A diglycidyl ether (BADGE) and bisphenol F diglycidyl ether (BFDGE) in canned liquid infant formula products in Canada and dietary intake estimates [J]. Journal of Aoac International, 2009, 92(6): 1780-1789. doi: 10.1093/jaoac/92.6.1780 [27] MUNGUIA-LOPEZ E M, SOTO-VALDEZ H. Effect of heat processing and storage time on migration of bisphenol A (BPA) and bisphenol A-diglycidyl ether (BADGE) to aqueous food simulant from Mexican can coatings [J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 3666-3671. doi: 10.1021/jf0009044 [28] SAFTA M, LIMAM I, BOUAJINA A, et al. Characterization of the migration of bisphenol A and F diglycidyl ethers from epoxy-coated containers to food simulants [J]. Analytical Letters, 2018, 51(3): 296-311. doi: 10.1080/00032719.2017.1331353 [29] XUE J C, VENKATESAN A K, WU Q, et al. Occurrence of bisphenol A diglycidyl ethers (BADGEs) and novolac glycidyl ethers (NOGEs) in archived biosolids from the US EPA's targeted national sewage sludge survey [J]. Environmental Science & Technology, 2015, 49(11): 6538-6544. [30] CHANG Y, NGUYEN C, PARANJPE V R, et al. Analysis of bisphenol A diglycidyl ether (BADGE) and its hydrolytic metabolites in biological specimens by high-performance liquid chromatography and tandem mass spectrometry [J]. Journal of Chromatography B, 2014, 965: 33-38. doi: 10.1016/j.jchromb.2014.06.005 [31] BENTLEY P, BIERI F, KUSTER H, et al. Hydrolysis of bisphenol A diglycidylether by epoxide hydrolases in cytosolic and microsomal fractions of mouse liver and skin: Inhibition by bis epoxycyclopentylether and the effects upon the covalent binding to mouse skin DNA [J]. Carcinogenesis, 1989, 10(2): 321-327. doi: 10.1093/carcin/10.2.321 [32] BOOGAARD P J, DENNEMAN M A, van SITTERT N J. Dermal penetration and metabolism of five glycidyl ethers in human, rat and mouse skin [J]. Xenobiotica, 2000, 30(5): 469-483. doi: 10.1080/004982500237488 [33] CLIMIE I J G, HUTSON D H, STOYDIN G. Metabolism of the epoxy resin component 2, 2-bis[4-(2, 3-epoxypropoxy)phenyl]propane, the diglycidyl ether of bisphenol a (DGEBPA) in the mouse.;Part I. A comparison of the fate of a single dermal application and of a single oral dose of 14C-DGEBPA [J]. Xenobiotica, 1981, 11(6): 391-399. doi: 10.3109/00498258109045850 [34] XUE J C, KANNAN K. Novel finding of widespread occurrence and accumulation of bisphenol A diglycidyl ethers (BADGEs) and novolac glycidyl ethers (NOGEs) in marine mammals from the United States coastal waters [J]. Environmental Science & Technology, 2016, 50(4): 1703-1710. [35] SUÁREZ S, SUEIRO R A, GARRIDO J. Genotoxicity of the coating lacquer on food cans, bisphenol A diglycidyl ether (BADGE), its hydrolysis products and a chlorohydrin of BADGE [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2000, 470(2): 221-228. doi: 10.1016/S1383-5718(00)00109-1 [36] RAMILO G, VALVERDE I, LAGO J, et al. Cytotoxic effects of BADGE (bisphenol A diglycidyl ether) and BFDGE (bisphenol F diglycidyl ether) on Caco-2 cells in vitro [J]. Archives of Toxicology, 2006, 80(11): 748-755. doi: 10.1007/s00204-006-0121-1 [37] BROWN S H J, EATHER S R, FREEMAN D J, et al. A lipidomic analysis of placenta in preeclampsia: Evidence for lipid storage [J]. PLoS One, 2016, 11(9): e0163972. doi: 10.1371/journal.pone.0163972 [38] RUSSO G, CAPUOZZO A, BARBATO F, et al. Cytotoxicity of seven bisphenol analogues compared to bisphenol A and relationships with membrane affinity data [J]. Chemosphere, 2018, 201: 432-440. doi: 10.1016/j.chemosphere.2018.03.014 [39] HEMMINKI K, VAINIO H. Alkylation of nucleic acid bases by epoxides and glycidyl ethers [J]. Developments in Toxicology and Environmental Science, 1980, 8: 241-244. [40] CANTER D A, ZEIGER E, HAWORTH S, et al. Comparative mutagenicity of aliphatic epoxides in Salmonella [J]. Mutation Research/Genetic Toxicology, 1986, 172(2): 105-138. doi: 10.1016/0165-1218(86)90069-8 [41] SUEIRO R A, SUÁREZ S, ARAUJO M, et al. Study on mutagenic effects of bisphenol A diglycidyl ether (BADGE) and its derivatives in the Escherichia coli tryptophan reverse mutation assay [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2006, 609(1): 11-16. doi: 10.1016/j.mrgentox.2006.05.012 [42] WILLIAMS M J, CAO H, LINDKVIST T, et al. Exposure to the environmental pollutant bisphenol A diglycidyl ether (BADGE) causes cell over-proliferation in Drosophila [J]. Environmental Science and Pollution Research, 2020, 27(20): 25261-25270. doi: 10.1007/s11356-020-08899-7 [43] WRIGHT H M, CLISH C B, MIKAMI T, et al. A synthetic antagonist for the peroxisome proliferator-activated receptor gamma inhibits adipocyte differentiation [J]. The Journal of Biological Chemistry, 2000, 275(3): 1873-1877. doi: 10.1074/jbc.275.3.1873 [44] CHAMORRO-GARCÍA R, KIRCHNER S, LI X, et al. Bisphenol A diglycidyl ether induces adipogenic differentiation of multipotent stromal stem cells through a peroxisome proliferator-activated receptor gamma-independent mechanism [J]. Environmental Health Perspectives, 2012, 120(7): 984-989. doi: 10.1289/ehp.1205063 [45] NAKAZAWA H, YAMAGUCHI A, INOUE K, et al. In vitro assay of hydrolysis and chlorohydroxy derivatives of bisphenol A diglycidyl ether for estrogenic activity [J]. Food and Chemical Toxicology, 2002, 40(12): 1827-1832. doi: 10.1016/S0278-6915(02)00165-5 [46] BRESLIN W J, KIRK H D, JOHNSON K A. Teratogenic evaluation of diglycidyl ether of bisphenol A (DGEBPA) in New Zealand White rabbits following dermal exposure [J]. Fundamental and Applied Toxicology, 1988, 10(4): 736-743. doi: 10.1016/0272-0590(88)90200-X [47] LYONS G. Bisphenol A: A Known Endocrine Disruptor. A WWF European Toxics Programme Report 2000 [EB/OL]. https://wwfeu.awsassets.panda.org/downloads/bisphenol.pdf. [48] YANG Y J, LEE S Y, KIM K Y, et al. Acute testis toxicity of bisphenol A diglycidyl ether in Sprague-Dawley rats [J]. Journal of Preventive Medicine and Public Health, 2010, 43(2): 131-137. doi: 10.3961/jpmph.2010.43.2.131 [49] HANAOKA T, KAWAMURA N, HARA K, et al. Urinary bisphenol A and plasma hormone concentrations in male workers exposed to bisphenol A diglycidyl ether and mixed organic solvents [J]. Occupational and Environmental Medicine, 2002, 59(9): 625-628. doi: 10.1136/oem.59.9.625 [50] XUE J C, LIU W B, KANNAN K. Bisphenols, benzophenones, and bisphenol A diglycidyl ethers in textiles and infant clothing [J]. Environmental Science & Technology, 2017, 51(9): 5279-5286. -



 下载:
下载:

