-
布雷菲德菌素A (Brefeldin A, BFA)被认为是一种新型抗癌药物,属真菌合成的大环内酯类抗生素[1-3],是青霉属、蓝青霉、棒曲霉等多种菌株的代谢产物。研究发现,BFA在前列腺癌、乳腺癌等细胞株的体外实验中表现出抗肿瘤活性[4-5],且其抗肿瘤机制与凋亡诱导作用相关。因此BFA作为一种新型抗肿瘤候选药物正引起越来越多人们的注意。
随着我国工业的发展,环境污染物如重金属和难降解有机污染物污染成为我国肝癌发病率居高不下的主要原因。研究表明,长期、低剂量摄入微囊藻毒素[6]、幽门螺杆菌感染[7]、环境中农药暴露[8]、苯并芘暴露[9]、砷暴露[10]以及氯化消毒副产物的暴露[11]等都与肝癌发生发展相关。有研究发现,BFA处理可引起HepG2发生明显而持久的内质网应激反应[12]。与内质网应激相关的蛋白激活转录因子4(ATF4)、C/EBP同源蛋白(CHOP)可通过自噬调控过程发挥抗肿瘤作用[13-14]。研究表明,ATF4介导的CHOP激活也可以诱导自噬相关蛋白5 (Atg5),Atg5对于自噬进程中的泛素化过程是必需的,它促进了Atg5-Atg12-Atg16L复合物的组装以及LC3从LC3-Ⅰ(自由形式)到LC3-Ⅱ(膜结合形式)的转化[15-16]。适度的自噬增加,可促进细胞进行物质更新,帮助细胞应对饥饿、低氧等不利的环境条件,而自噬水平的显著上调会大量消耗细胞中的细胞器,同时产生大量的空泡,最终导致细胞死亡,即自噬性细胞死亡(ACD)。那么BFA能否通过ATF4/CHOP通路激活HepG2细胞内的自噬水平并引起细胞死亡呢?为此,本实验室以人肝母细胞瘤细胞株HepG2细胞作为模型,探讨BFA对HepG2细胞内相关分子的影响,为进一步探讨BFA的抗肿瘤作用奠定基础。
-
人肝母细胞瘤细胞株HepG2,购于中国科学院上海细胞生物研究所干细胞库。零下80 ℃低温冰箱(中科美菱);CO2培养箱Galaxy170S(德国Eppendorf);高速低温离心机Neofuge 15R(Heal Force);全自动高压锅 G154TW(厦门Zealway仪器公司);倒置荧光显微镜 BX51(日本Olympus公司);酶标仪Model 680(美国Bio-rad company);电泳槽(上海Tanon公司);多功能化学发光成像分析系统BG-gdsAUTO 720(北京百晶生物技术有限公司)。
MTT粉末、BCA蛋白定量试剂盒、蛋白酶抑制剂(普通/磷酸化)(武汉博士德公司);DMEM高糖培养基(美国Hyclone公司);胎牛血清(以色列Biological Industries);增强化学发光法(ECL)发光液(武汉博士德公司)。BFA(上海碧云天生物技术有限公司);二甲基亚砜(美国sigma公司);胰蛋白酶(北京索莱宝生物科技有限公司)。高蛋白脱脂高钙奶粉(400 g,内蒙古伊利实业集团股份有限公司)。
-
将HepG2细胞接种于含10%胎牛血清、100 U·mL−1青霉素和100 U·mL−1链霉素的DMEM完全培养基中,于37 ℃、5% CO2湿润培养箱中培养。每1—2 d传代1次,取对数生长期的细胞进行实验。
-
于96孔板中接种细胞,培养24 h后,设置阴性对照组、0.1% DMSO组(溶剂对照)、BFA处理组(BFA浓度为0.09、0.36、0.9、1.8、3.6、9.0 μmol·L−1)。每组6个平行,处理6 h、24 h、48 h后,吸弃旧的培养基,用1 × PBS漂洗3次;更换90 μL新鲜培养基,每孔加入10 μL MTT染液,继续培养4 h后,每孔加入100 μL DMSO溶解液至完全溶解,于490 nm波长处测吸光度(OD),按下式计算细胞活性,式中OD为吸光度:
细胞活性(%) =(染毒组OD值−空白组OD值)/(对照组OD值−空白组OD值)×100%
-
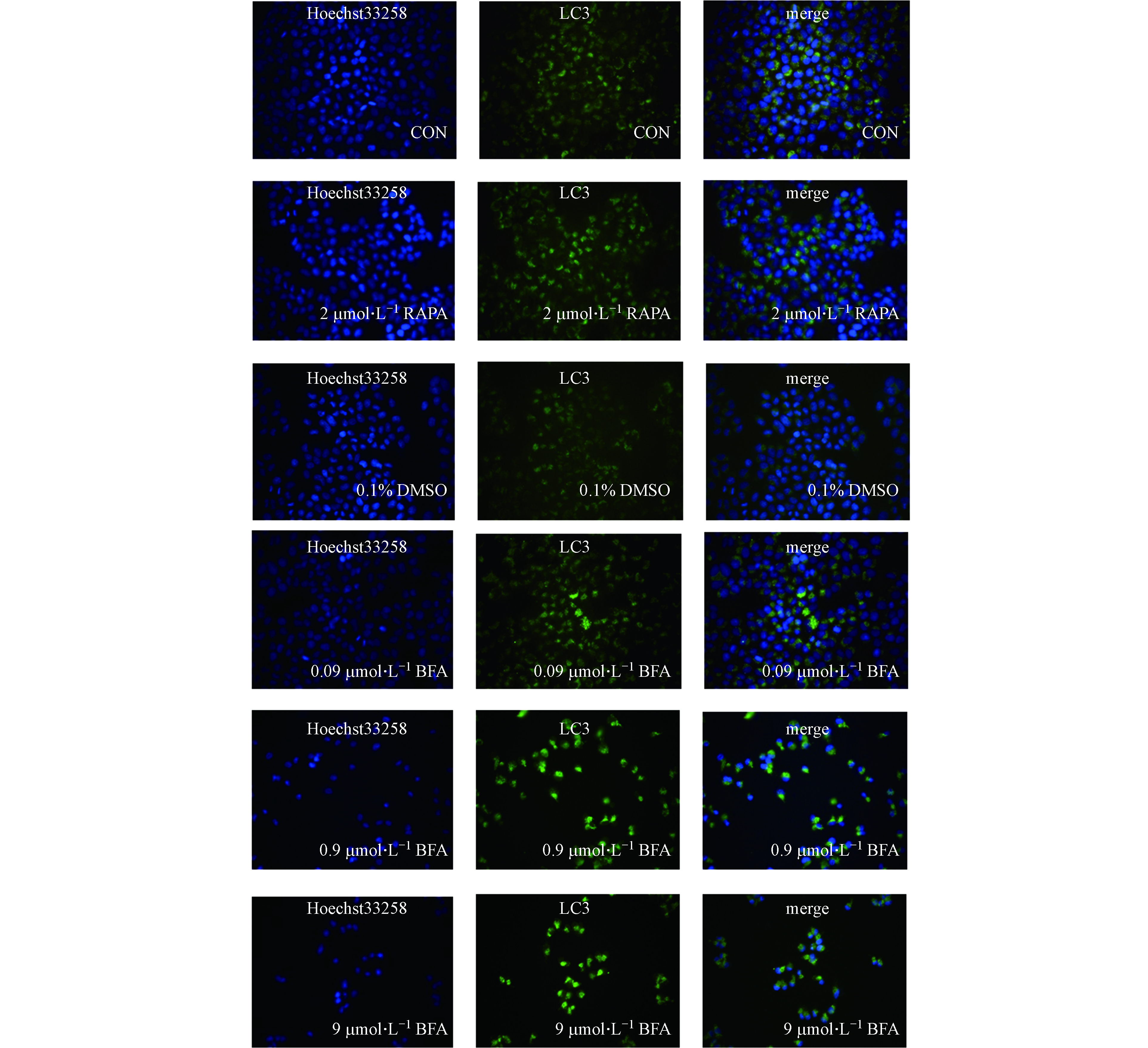
取对数生长期HepG2细胞接种于24孔板中,在细胞毒性试验的基础上,用不同浓度BFA处理组(0.09、0.9、9.0 μmol·L−1)处理48 h,并以2 μmol·L−1 雷帕霉素(RAPA)作为阳性对照组、0.1%DMSO作为溶剂对照组、完全培养基作为阴性对照组,每组设置3个平行。处理结束后,磷酸缓冲盐溶液(1×PBS, 0.01 mol·L−1)清洗3次(每孔1 mL,每次5 min);每孔加1 mL 4 ℃预冷的4%多聚甲醛,室温固定20 min;1×PBS清洗洗3次(每孔1 mL/孔,每次5 min)。每孔加入300 μL稀释为0.1 %的 Triton X-100,10 min后再次用1×PBS清洗,方法参考上一步骤;用山羊血清(每孔300 μL,稀释为4%)在室温状态下封闭2 h;加一抗(每孔300 μL,LC3,1∶200)过夜。吸掉一抗,1×PBS清洗3次(每孔1 mL,每次5 min),接下来的步骤需要避光,加入荧光二抗(每孔300 μL),室温条件下反应30 min。1×PBS清洗3次(每孔1 mL,每次5 min),双蒸水洗2次(每孔1 mL,每次5 min);加入300 μL 10 μg·mL−1的Hoechst33258溶液,室温避光作用15 min;1×PBS清洗3次(每孔1 mL,每次5 min),双蒸水洗2次(每孔1 mL,每次5 min);添加抗荧光衰减剂后用指甲油固定。选择不同的镜头视野,调整合适的焦距和曝光度后,先观察细胞质,再观察细胞核。观察结束后用锡箔纸将样本密封好,放在4 ℃冰箱里,以便后续继续观察。用Image J软件测定平均荧光强度。
-
取对数生长期HepG2细胞接种于6孔板中,用不同浓度BFA处理组(0.09、0.9、9.0 μmol·L−1)处理48 h,并以2 μmol·L−1 雷帕霉素(RAPA)作为阳性对照组、0.1%DMSO作为溶剂对照组、完全培养基作为阴性对照组,每组设置3个平行。处理完成后,加入配好的细胞提取液直到细胞被充分裂解,将液体收集至1.5 mL离心管中,用BCA法进行蛋白定量。实验时,LC3的分离胶浓度为18%,80 V恒压电泳直到指示marker分离出现最小的10 kD指示条带,300 mA恒流30 min转移到NC膜。其余蛋白质的分离胶浓度均为12%,80 V恒压电泳1.5 h左右,400 mA恒流1.5 h转移到PVDF膜。将2.5 g脱脂奶粉溶于50 mL 1×PBST缓冲液中,配成5%的脱脂奶粉封闭液,将转好的膜放在肥皂盒中,按照每张膜25 mL封闭液,在摇床上缓慢摇晃封闭2 h。加入提前配好的一抗溶液,放在4 ℃冰箱里缓慢摇晃过夜。第二天回收一抗后,用PBST清洗3次,加入提前配好的二抗溶液,摇床上缓慢摇晃孵育50 min后,再次用PBST清洗3次。加ECL发光液后于多功能化学发光成像分析系统BG-gdsAUTO 720显影。用 Image-Pro Plus 6. 0 图像分析软件进行蛋白表达的半定量分析。抗体信息见表1。
-
使用SPSS24.0进行数据分析。所有实验结果均以均数±标准差(mean ± SD)表示。多组间比较采用单因素方差分析(ANOVA),组间两两比较用LSD检验,检验水准为0.05。
-
原发性肝癌(hepatocellular carcinoma, HCC)是我国最常见的消化系统恶性肿瘤,居我国肿瘤致死病因的第三位[17],我国也是全球肝癌发病率最高的国家[18]。目前临床上HCC在发现时能够进行切除术治疗的患者仅有10%[19]。因此控制危险环境因素的暴露和积极寻找治疗肝脏肿瘤的化学药物都具有重要的意义。BFA是抑制蛋白质转运的分子工具,在体外实验中表现出一定的抗肿瘤潜力,且其抗肿瘤作用与凋亡诱导作用相关。因此我们检测了BFA对人源性肝母细胞瘤细胞株HepG2细胞毒性效应的相关指标,初步探讨其作为肝癌治疗药物的可能性。由表2可知,BFA处理HepG2细胞6 h后,与阴性对照组相比,细胞活性无明显变化。BFA处理HepG2细胞24 h及48 h后,与阴性对照组和0.1% DMSO相比,0.36 μmol·L−1 BFA引起HepG2细胞的活力明显降低,差异有统计学意义(P<0.05),说明BFA对HepG2细胞具有明显的毒性效应,并且随着BFA剂量的增加,细胞活力递减。细胞处理48 h后,细胞活性降低明显,因此选择处理48 h进行研究探索。
-
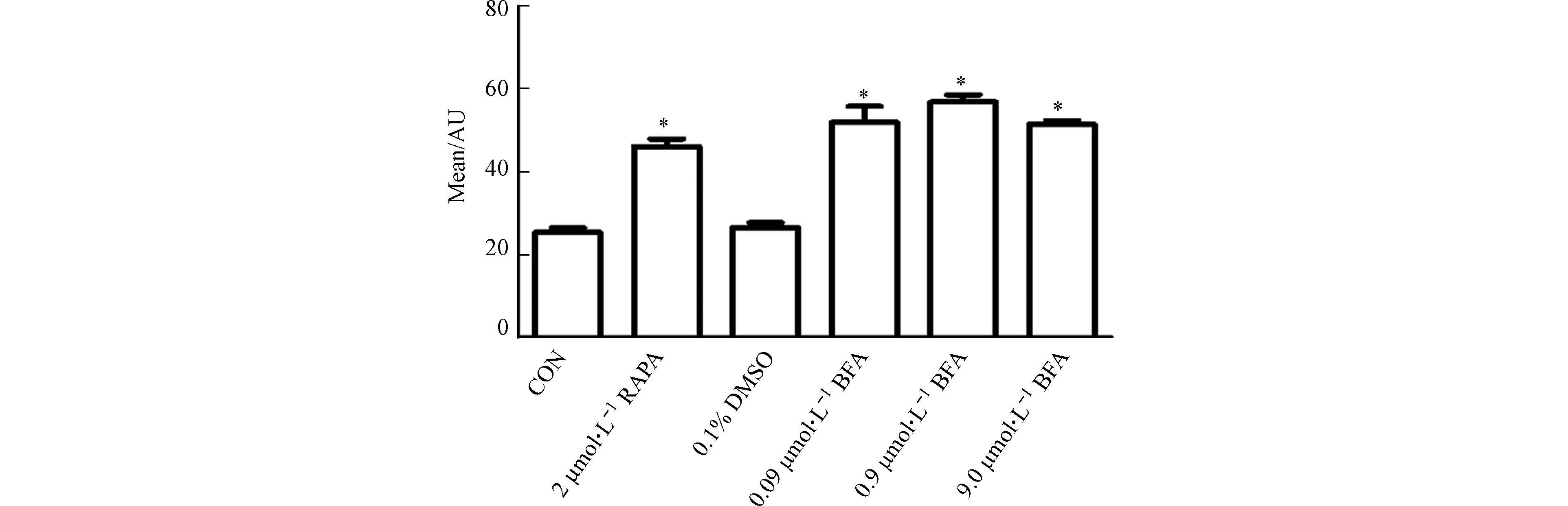
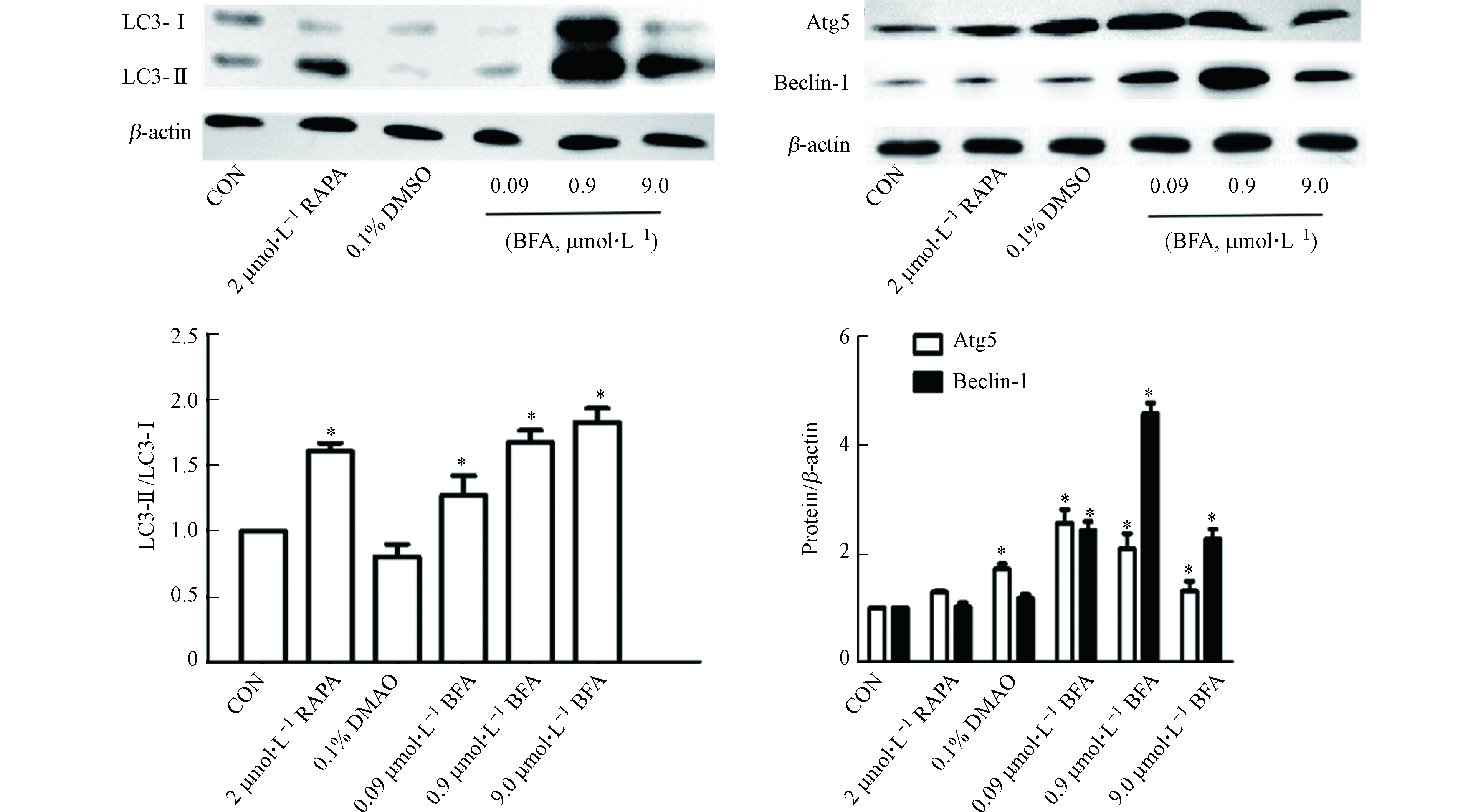
研究表明,过度的自噬激活无益于细胞存活,最终导致细胞死亡,即出现自噬性细胞死亡[20]。因此还观察了BFA对HepG2细胞自噬的影响。细胞自噬体形成过程中,LC3经过翻译后修饰,形成LC3-Ⅰ和LC3-Ⅱ两种亚型,其中LC3-Ⅰ分布于细胞质中,而LC3-Ⅱ则存在于自噬体膜内外。细胞中LC3-Ⅱ的水平与自噬小体的形成的程度相关,它被认为是哺乳动物自噬细胞的标志物[21-22]。如图1所示,BFA处理48 h时后,与阴性对照组相比,BFA上调细胞内LC3-Ⅱ的蛋白表达水平,阳性对照组RAPA组LC3-Ⅱ的蛋白表达水平也增加。同时3个BFA处理组自噬相关蛋白Atg5、Beclin-1的蛋白表达水平也明显升高,而RAPA组却无明显改变。如图2所示,绿色荧光代表LC3,蓝色荧光代表细胞核,merge是二者的合并图。由图2可见,阴性对照组的绿色荧光散在分布于细胞核外周,而经过BFA和RAPA处理后,绿色荧光中出现亮度更高的点状聚集光团,并且BFA处理组的绿色荧光都聚集在细胞核的某一侧。同时,阴性对照组和溶剂对照组处理的细胞核饱满,而BFA处理组的细胞数量减少,细胞核变形固缩。由图3可知,与阴性对照组相比,RAPA和BFA使HepG2细胞中绿色荧光的平均荧光强度增加。
-
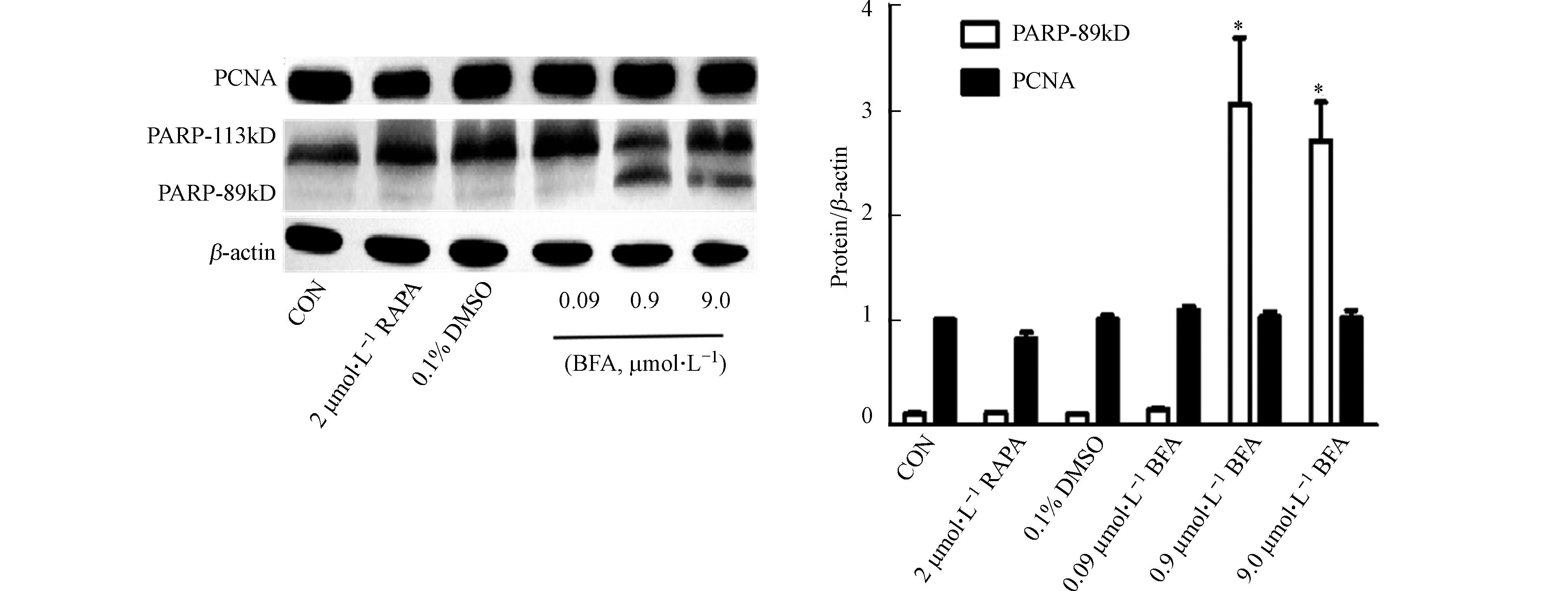
聚(腺苷二磷酸-核糖)多聚酶(PARP)是DNA修复蛋白,当存在DNA广泛损伤时,可发挥促进凋亡作用,其活化型PARP-89kD常作为凋亡标志蛋白辅助观察细胞凋亡变化[23-24]。增殖细胞核抗原(PCNA)与细胞DNA的合成密切相关,对细胞增殖的启动起重要作用,可用于反应细胞的增殖状态[25]。如图4所示,BFA处理HepG2 48 h后,与阴性对照组相比,BFA使PARP-89kD的蛋白表达水平增加,细胞核增殖抗原(PCNA)的蛋白表达水平无明显改变。说明BFA可引起HepG2细胞凋亡,对细胞增殖无明显影响。
-
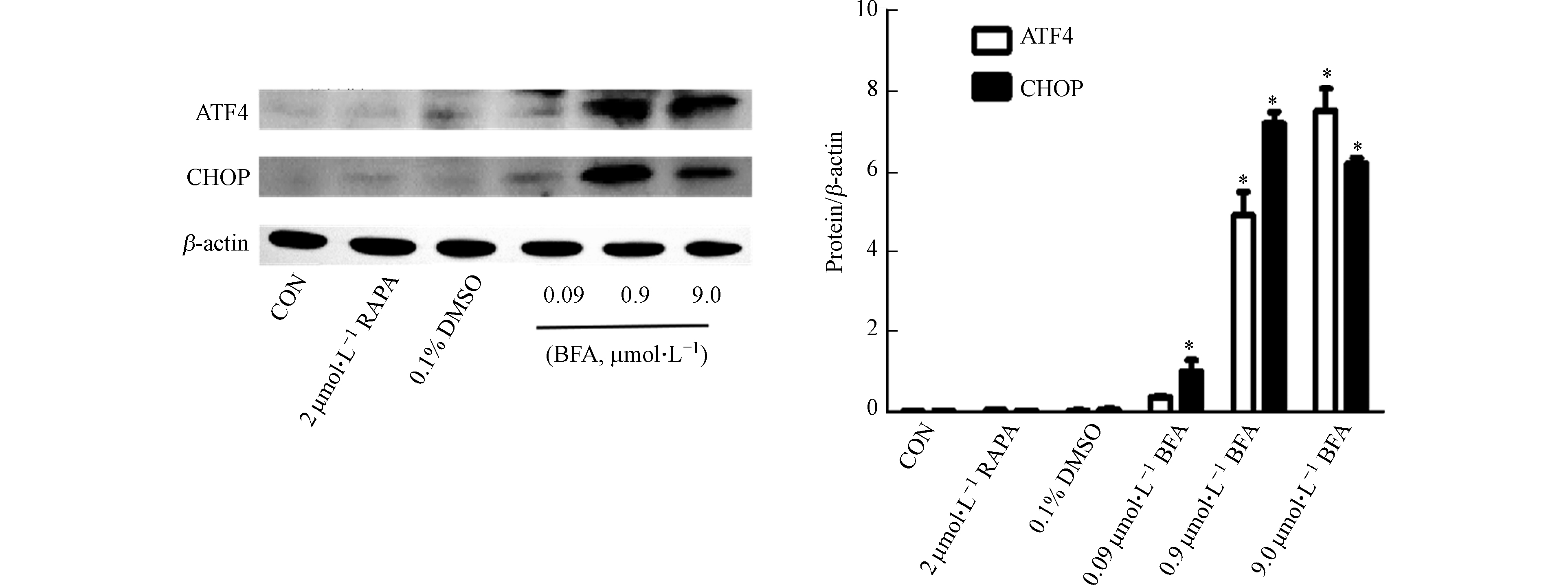
实验室前期证实BFA能够引起BiP表达明显升高[12],说明BFA引起HepG2细胞内质网应激。随着内质网应激的持续激活,ATF4的翻译水平增强[26]。ATF4诱导CHOP的表达,CHOP对细胞凋亡的诱导发挥不可替代的作用[27]。ATF4和CHOP的高表达诱导Atg5的高表达,Atg5促进了自噬过程中Atg5-Atg12-Atg16L复合物的组装和LC3的裂解及脂化,进而诱导自噬[16, 28]。由图5可知,BFA处理48 h后,与阴性对照组相比,BFA使HepG2细胞内ATF4和CHOP的蛋白表达水平明显升高。
-
本次研究结果显示,BFA处理HepG2细胞后,细胞活性降低、细胞数量明显减少、细胞核明显固缩和变形,同时PARP-89kD的表达量增加明显,而PCNA的表达无明显变化。这说明BFA对HepG2细胞存活具有明显的抑制作用,且能诱导HepG2细胞发生凋亡,但是BFA并不影响HepG2细胞的增殖过程。这说明,与前列腺癌细胞株等观察结果类似,BFA对HepG2细胞也具有一定抑制作用。进一步研究发现HepG2细胞内自噬相关蛋白LC3-II、Beclin-1和Atg5的蛋白表达水平升高,HepG2细胞内的自噬水平增加;同时ATF4、CHOP的蛋白表达水平也显著增加,这说明BFA诱导HepG2细胞内ATF4和CHOP的过表达。综上所述,本实验认为BFA通过引起HepG2细胞内ATF4和CHOP的过表达增加HepG2细胞内的自噬水平,最终导致HepG2细胞自噬性细胞死亡。
布雷菲德菌素A对HepG2细胞自噬的诱导作用
Study of brefeldin a on induction of autophagy in HepG2 Cells
-
摘要: 为探讨新型抗癌药物布雷菲德菌素A(BFA)诱导肝癌细胞发生自噬性死亡的作用机制,以HepG2细胞作为研究对象,将细胞分成阴性对照组、不同浓度BFA组和阳性对照组(雷帕霉素),采用MTT法测定HepG2细胞活性;采用免疫荧光法检测细胞内自噬标志蛋白LC3的表达和细胞核形态学改变;采用Western Blot法检测细胞内激活转录因子4(ATF4)、C/EBP同源蛋白(CHOP)、聚(腺苷二磷酸-核糖)多聚酶(PARP)、增殖细胞核抗原(PCNA)、微管相关蛋白1轻链3(LC3)、自噬相关蛋白5(Atg5)、自噬相关蛋白6(Atg6/Beclin-1)的表达水平。结果表明,BFA可引起HepG2细胞内自噬特征蛋白LC3-Ⅱ、Atg5、Beclin-1的蛋白表达水平明显增加;同时引起HepG2细胞活性降低、细胞数量减少、细胞核固缩和变形。说明BFA可能引起HepG2细胞发生自噬性细胞死亡。进一步探讨自噬诱导途径发现,BFA引起HepG2细胞内ATF4、CHOP的蛋白表达水平增加。BFA可能通过诱导ATF4和CHOP的过表达引起HepG2细胞发生自噬性细胞死亡。Abstract: To investigate the mechanism of the new anticancer drug Brefeldin A (BFA) induced autophagic cell death in HepG2 cells. MTT assay was used to measure the activity of HepG2 cells. The immunofluorescence method was used to observed the expression of LC3 and nuclear morphological changes. Measurement of activating transcription factor 4 (ATF4), C/EBP homologous protein (CHOP), poly ADP-ribose polymerase (PARP), proliferating cell nuclear antigen (PCNA), microtubule-associated protein 1 light chain 3 (LC3), autophagy related 5 homolog (Atg5), autophagy related 6 homolog (Atg6/Beclin-1) by Western blot. The results showed that BFA could significantly increase the expression levels of autophagy characteristic proteins LC3-Ⅱ, Atg5 and Beclin-1 in HepG2 cells; At the same time, it caused the decrease of HepG2 cell activity, cell number reduction, nucleus pyknosis and deformation. These results suggest that BFA may cause autophagic cell death in HepG2 cells. Further exploration of the autophagy induction pathway found that BFA caused an increase in the protein expression levels of ATF4 and CHOP in HepG2 cells. The above results suggest that BFA may induce autophagic cell death in HepG2 cells by inducing the overexpression of ATF4 and CHOP.
-

-
表 1 抗体信息
Table 1. Information of Antibody
名称
Name公司
Company编号
No.稀释比
Dilution ratioMouse anti-human β-actin BOSTER, Wuhan BM0005 1∶2000 Rabbit anti-human LC3 Protein Tech, China 14600-1-AP 1∶1000 Mouse anti-human PCNA BOSTER, Wuhan BM0104 1∶1000 Mouse anti-human BECN1 BBI Life Sciences, China D190707 1∶1000 Rabbit anti-human PARP CST, America 9542 1∶1000 Mouse anti-human ATG5 Protein Tech, China 66744-1-lg 1∶1000 Rabbit anti-human CHOP Protein Tech, China 15204-1-AP 1∶500 Rabbit anti-human ATF4 Protein Tech, China 10835-1-AP 1∶1000 Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) CST, America 4412 1∶2000 HRP-conjugated Goat anti-rabbit IgG BOSTER, Wuhan BA1054 1∶5000 HRP-conjugated Goat anti-mouse IgG BOSTER, Wuhan BA1050 1∶5000 表 2 BFA对HepG2细胞活性的影响(
$\bar x \pm s $ Table 2. Effect of BFA on the activity of HepG2 cells (
$\bar x \pm s $ 组别
Group细胞活性/% Activity 6 h 24 h 48 h CON 100 100 100 0.1% DMSO 112.43 94.99 105.63 0.09 μmol·L-1 BFA 110.42 91.66* 98.84 0.36 μmol·L-1 BFA 107.39 75.34*# 64.34*# 0.9 μmol·L-1 BFA 103.03 72.31*# 54.30*# 1.8 μmol·L-1 BFA 106.55 68.87*# 54.19*# 3.6 μmol·L-1 BFA 101.16 67.15*# 51.10*# 9.0 μmol·L-1 BFA 109.56 63.53*# 39.30*# F 1.217 154.142 144.577 P 0.316 <0.001 <0.001 注:*,与阴性对照组相比,P<0.05;#,与0.1% DMSO组相比,P<0.05.
Note: *,Compared with negative control group, P < 0.05;#,Compared with 0.1% DMSO group, P < 0.05. -
[1] SINGLETON V L, BOHONOS N, ULLSTRUP A J. Decumbin, a new compound from a species of Penicillium [J]. Nature, 1958, 181(4615): 1072-1073. doi: 10.1038/1811072a0 [2] HELMS J B, ROTHMAN J E. Inhibition by brefeldin A of a Golgi membrane enzyme that catalyses exchange of guanine nucleotide bound to ARF [J]. Nature, 1992, 360(6402): 352-354. doi: 10.1038/360352a0 [3] NOJIRI H, MANYA H, ISONO H, et al. Induction of terminal differentiation and apoptosis in human colonic carcinoma cells by brefeldin A, a drug affecting ganglioside biosynthesis [J]. FEBS Letters, 1999, 453(1/2): 140-144. [4] LEE S A, KIM Y J, LEE C S. Brefeldin a induces apoptosis by activating the mitochondrial and death receptor pathways and inhibits focal adhesion kinase-mediated cell invasion [J]. Basic & Clinical Pharmacology & Toxicology, 2013, 113(5): 329-338. [5] HUANG H R, LIU T, GUO J X, et al. Brefeldin A enhances docetaxel-induced growth inhibition and apoptosis in prostate cancer cells in monolayer and 3D cultures [J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(11): 2286-2291. [6] 张萍, 钟儒刚, 崔海信, 等. 微囊藻毒素诱发癌症的作用机制研究进展 [J]. 癌变. 畸变. 突变, 2009, 21(1): 70-73. ZHANG P, ZHONG R G, CUI H X, et al. Research progress on the mechanism of microcystin induced cancer [J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2009, 21(1): 70-73(in Chinese).
[7] 张福星, 张思宇, 苏国强, 等. 幽门螺杆菌感染与原发性肝癌侵袭转移的关系 [J]. 临床肿瘤学杂志, 2010, 15(2): 123-126. doi: 10.3969/j.issn.1009-0460.2010.02.007 ZHANG F X, ZHANG S Y, SU G Q, et al. Relationship between the infection of Helicobacter pylori and the invasion and metastasis of primary hepatocellular carcinoma [J]. Chinese Clinical Oncology, 2010, 15(2): 123-126(in Chinese). doi: 10.3969/j.issn.1009-0460.2010.02.007
[8] 陈佳鹏, 周宝森. 农业地区人群恶性肿瘤发病率和死亡率与环境中农药暴露的生态学研究 [J]. 中国慢性病预防与控制, 2004, 12(2): 52-54. doi: 10.3969/j.issn.1004-6194.2004.02.002 CHEN J P, ZHOU B S. Morbidity and mortality in agricultural area associated with environmental pesticide exposure [J]. Chinese Journal of Prevention and Control of Chronic Non-Communicable Diseases, 2004, 12(2): 52-54(in Chinese). doi: 10.3969/j.issn.1004-6194.2004.02.002
[9] 李欣欣. 环境化学物诱发氧化损伤致癌机制的探索性研究[D]. 北京: 中国疾病预防控制中心, 2011: 1-77. LI X X. The role of oxidative damage induced by environmental chemicals in environmental carcinogenesis[D]. Beijing: Chinese Center for Disease Control and Prevention, 2011: 1-77(in Chinese)
[10] 周晓倩, 何云, 吴君. 砷中毒所致氧化应激与肝脏损伤 [J]. 中华地方病学杂志, 2007, 26(1): 114-116. doi: 10.3760/cma.j.issn.1000-4955.2007.01.046 ZHOU X Q, HE Y, WU J. Oxidative stress and liver injury caused by arsenic poisoning [J]. Chinese Journal of Endemic Diseases, 2007, 26(1): 114-116(in Chinese). doi: 10.3760/cma.j.issn.1000-4955.2007.01.046
[11] 林辉, 刘建平. 饮水氯化消毒及其副产物的研究进展及展望 [J]. 中国公共卫生, 2001, 17(11): 85-86. doi: 10.3321/j.issn:1001-0580.2001.11.048 LIN H, LIU J P. Research progress and Prospect of chlorination disinfection of drinking water and its by products [J]. China Public Health, 2001, 17(11): 85-86(in Chinese). doi: 10.3321/j.issn:1001-0580.2001.11.048
[12] 雒玉霞, 刘艳飞, 王盼, 等. 布雷菲尔德菌素A经内质网应激途径诱导的肝癌细胞HepG2发生p53依赖性死亡 [J]. 环境卫生学杂志, 2020, 10(1): 1-8,42. doi: 10.13421/j.cnki.hjwsxzz.2020.01.001 LUO Y X, LIU Y F, WANG P, et al. Brefeldin A-induced p53-dependent death in hepatocellular carcinoma cells HepG2 via endoplasmic Reticulum stress pathway [J]. Journal of Environmental Hygiene, 2020, 10(1): 1-8,42(in Chinese). doi: 10.13421/j.cnki.hjwsxzz.2020.01.001
[13] KIM M H, AYDEMIR T B, COUSINS R J. Dietary zinc regulates apoptosis through the phosphorylated eukaryotic initiation factor 2α/activating transcription factor-4/C/EBP-homologous protein pathway during pharmacologically induced endoplasmic Reticulum stress in livers of mice [J]. The Journal of Nutrition, 2016, 146(11): 2180-2186. doi: 10.3945/jn.116.237495 [14] FELS D R, KOUMENIS C. The PERK/eIF2alpha/ATF4 module of the UPR in hypoxia resistance and tumor growth [J]. Cancer Biology & Therapy, 2006, 5(7): 723-728. [15] HAN J, BACK S H, HUR J, et al. ER-stress-induced transcriptional regulation increases protein synthesis leading to cell death [J]. Nature Cell Biology, 2013, 15(5): 481-490. doi: 10.1038/ncb2738 [16] KOUROKU Y, FUJITA E, TANIDA I, et al. ER stress (PERK/eIF2alpha phosphorylation) mediates the polyglutamine-induced LC3 conversion, an essential step for autophagy formation [J]. Cell Death and Differentiation, 2007, 14(2): 230-239. doi: 10.1038/sj.cdd.4401984 [17] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012 [J]. CA:a Cancer Journal for Clinicians, 2015, 65(2): 87-108. doi: 10.3322/caac.21262 [18] 赵文江, 张晓磷, 赵苗. 原发性肝癌肺转移的治疗进展 [J]. 海南医学, 2018, 29(1): 87-90. doi: 10.3969/j.issn.1003-6350.2018.01.027 ZHAO W J, ZHANG X L, ZHAO M. Advances in the treatment of pulmonary metastasis from hepatocellular carcinoma [J]. Hainan Medical Journal, 2018, 29(1): 87-90(in Chinese). doi: 10.3969/j.issn.1003-6350.2018.01.027
[19] 林威宏, 王家平. 原发性肝癌的介入治疗现状及展望 [J]. 云南医药, 2018, 39(4): 361-364. LIN W H, WANG J P. Current situation and Prospect of interventional therapy for primary liver cancer [J]. Medicine and Pharmacy of Yunnan, 2018, 39(4): 361-364(in Chinese).
[20] 王欣琦, 贾颜鸿, 周童, 等. 自噬性细胞死亡与凋亡相互影响作用的研究进展 [J]. 中国实验诊断学, 2020, 24(12): 2058-2061. doi: 10.3969/j.issn.1007-4287.2020.12.042 WANG X Q, JIA Y H, ZHOU T, et al. Research progress on the interaction between autophagic cell death and apoptosis [J]. Chinese Journal of Laboratory Diagnosis, 2020, 24(12): 2058-2061(in Chinese). doi: 10.3969/j.issn.1007-4287.2020.12.042
[21] KABEYA Y. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing [J]. The EMBO Journal, 2000, 19(21): 5720-5728. doi: 10.1093/emboj/19.21.5720 [22] TANIDA I, UENO T, KOMINAMI E. LC3 conjugation system in mammalian autophagy [J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(12): 2503-2518. [23] 苏姗. PARP-1和EMT在卵巢癌中的生物学功能及意义[D]. 济南: 山东大学, 2017: 1-89. SU S. Functional and mechanistic investigation of PARP-1 and EMT in ovarian cancer[D]. Jinan: Shandong University, 2017: 1-89. (in Chinese)
[24] 白冰心, 徐浩铨, 吴梦婷, 等. PARP-1和氟诱导成骨细胞凋亡的相关性研究 [J]. 疾病预防控制通报, 2021, 36(3): 1-5. doi: 10.13215/j.cnki.jbyfkztb.2101031 BAI B X, XU H Q, WU M T, et al. Study on correlation between PARP-1 and fluorideinduced osteoblast apoptosis [J]. Bulletin of Disease Control & Prevention (China), 2021, 36(3): 1-5(in Chinese). doi: 10.13215/j.cnki.jbyfkztb.2101031
[25] de BIASIO A, BLANCO F J. Proliferating cell nuclear antigen structure and interactions: Too many partners for one dancer? [J]. Advances in Protein Chemistry and Structural Biology, 2013, 91: 1-36. doi: 10.1016/B978-0-12-411637-5.00001-9 [26] HARDING H P, NOVOA I, ZHANG Y H, et al. Regulated translation initiation controls stress-induced gene expression in mammalian cells [J]. Molecular Cell, 2000, 6(5): 1099-1108. doi: 10.1016/S1097-2765(00)00108-8 [27] MARCINIAK S J. CHOP induces death by promoting protein synthesis and oxidation in the stressed endoplasmic Reticulum [J]. Genes & Development, 2004, 18(24): 3066-3077. [28] HARDING H P, ZHANG Y H, BERTOLOTTI A, et al. Perk is essential for translational regulation and cell survival during the unfolded protein response [J]. Molecular Cell, 2000, 5(5): 897-904. doi: 10.1016/S1097-2765(00)80330-5 -



 下载:
下载: