-
细胞色素P450(cytochrome,CYP450)是一种需要亚铁血红素(HEM)活化氧,以硫醇盐结合血红素为活性中心催化氧原子转移的氧化还原酶[1-2]。活性中心HEM的铁离子一侧与半胱氨酸的硫络合,另一侧可与水中的氧分子络合。半腕氨酸可与亚铁血红素中的铁元素形成硫醇盐离子键,成为铁的一个配体。这也是细胞色素P450中的铁能与一氧化碳络合,并在450 nm存在特征吸收的原因。
CYP3A4是CYP家族中最重要的一种,其活性在人类肝脏中占总CYP活性的60%,CYP3A4酶含量及酶活性存在较大的个体差异。CYP3A4在肝脏表达量最丰富,在人前列腺、乳腺、消化道、结肠及小肠组织液同样有很高的表达。现已经发现CYP3A4参与多种药物的代谢,并且在人群中广泛存在着遗传多态性,是引起个体间和种族间对同一底物代谢能力不同的原因之一。
己烯雌酚(Diethylstilbestrol,DES)作为一种合成的雌激素,具有比雌二醇更强的雌激素活性[3-4]。20世纪40年代起,己烯雌酚主要作为鸡、牛等的增肉剂,鱼类的生长促进剂[5-6],它在生物体内不易降解,会通过食物链富集,严重危害到人类健康[7]。在上世纪七八十年代,己烯雌酚作为类雌激素药物广泛运用于口服避孕,以及防止流产。后有研究发现其是一种内分泌干扰物,DES暴露对人类和动物有很强的负面影响。1971年,己烯雌酚被发现可诱发多种女性疾病遭到禁用[8]。1998年,蒋义国等发现己烯雌酚可能是一种促癌因子,会提高其他致癌物质的致癌性[9]。有研究发现孕期服用DES会影响胎儿生殖器官发育,也可能增加胎儿患生殖道癌症的风险。
DES是脂溶性物质,容易在动物体内残留,即使排出体外也会在水源和土壤中富集,造成环境污染恶性循环,并且食用含有DES残留的动物产品也会增加患癌的风险[10]。Hu等通过计算模拟研究己烯雌酚及其类似物对胰腺脂肪酶作用机理,结果得到己烯雌酚及其类似物对胰腺脂肪酶有抑制作用,可能对哺乳动物脂质吸收和体重增加起重要作用[11]。
由于DES的药理作用及其成本较低,DES仍然用于临床实践和动物中,CYP3A4酶作为一种重要的药物代谢酶,参与多种药物代谢。本文采用计算模拟和光谱法,从理论和实验来探究在模拟人体环境条件下,DES和CYP3A4酶的相互作用机制。从分子水平了解CYP3A4和DES的相互作用,为进一步研究DES对生命体造成的危害及其毒理作用打下基础。
-
CYP3A4(ID: 4K9T),无需进一步纯化。以5.0×10−3 mol·L−1 Tris-HCl缓冲液(pH=7.4)配制游离CYP3A4酶的浓度为10−6 mol·L−1。用甲醇配制己烯雌酚储备液浓度为10−6 mol·L−1。
-
CYP3A4晶体结构从蛋白数据库中下载PDB格式(ID:4K9T),己烯雌酚的3D配体结构通过ChemBioDraw Ultra 软件绘制,再进行几何优化。
使用AutoDock4.2软件进行分子对接,对接的格子大小为11.6 nm×11.6 nm×11.6 nm,先进行Autogrid计算格点能量,采用拉马克遗传算法;然后AutoDock对配体在BOX范围内进行构象搜索,进行评分得出结果。CYP3A4与DES用半经验的自由能计算方法评价,其他参数为默认值。最后使用Ligplot+进行相互作用力分析。
-
分子动力学模拟在Linux 系统中的GROMACS 4.6软件上进行。对CYP3A4和CYP3A4-DES复合物进行50 ns的MD 模拟。采用GROMOS96 43A1力场,使用SPC水模型和立方体水盒子(newbox),蛋白质与水盒子壁的最小距离为1 nm,若系统总电荷为负,加入Na+;反之系统总电荷为正,则加入Cl−,以提供电荷中性的系统;用最陡下降法进行初始结构的能量最小化;采用正则系统(NVT)和等温等压系统(NPT)平衡体系[12-13]。最后使用Origin 软件进行结果分析。
-
使用Cary Eclipse荧光分光光度计,用10 mm的石英比色皿进行实验。固定CYP3A4的浓度不变,改变DES的浓度。向2 mL CYP3A4酶(浓度为10−6 mol·L−1)加入不同体积(10、20、40、60、80、100 μL)的DES(10−8 mol·L−1)。分别扫描CYP3A4和CYP3A4-DES混合物,在3个温度290、300、310 K,扫描速度1200 nm·min−1、电压700 V及反应时间2 s条件下的荧光强度。设置参数:激发波长为280 nm,发射波长范围300—450 nm,步长和狭缝均为5 nm。
每个测得的光谱减去Tris-HCl缓冲液的发射光谱以获得背景荧光校正。
-
使用液体涂膜法,依次扫描4个样品:Tris-HCl缓冲液、10−6 mol·L−1游离CYP3A4酶、10−6 mol·L−1游离DES和CYP3A4-DES混合物(摩尔比1∶1)
游离CYP3A4的光谱等于CYP3A4在缓冲液中的光谱减去缓冲液的光谱;CYP3A4与DES反应后的差异光谱等于CYP3A4与DES混合物光谱减去游离DES的光谱,在傅立叶自我卷积后,进一步处理酰胺I带[14]。使用二阶导数法获得拟合曲线,并通过相应特征峰的面积计算CYP3A4每个二级结构的含量。
-
使用TU-1950紫外可见分光光度计,在室温下,移取2 mL 10−6 mol·L−1的CYP3A4储备液于光程为10 mm的石英比色皿中,依次加入不同体积的DES溶液,反应时间为2 s,扫描190-450 nm范围内的UV-Vis吸收光谱
以缓冲溶液作为背景,扫描记录10−6 mol·L−1游离的CYP3A4、10−6 mol·L−1游离的DES和CYP3A4-DES(物质的量比1∶1)在190—450 nm波长范围的吸光度,分析吸收光谱的变化及复合物的形成。
-
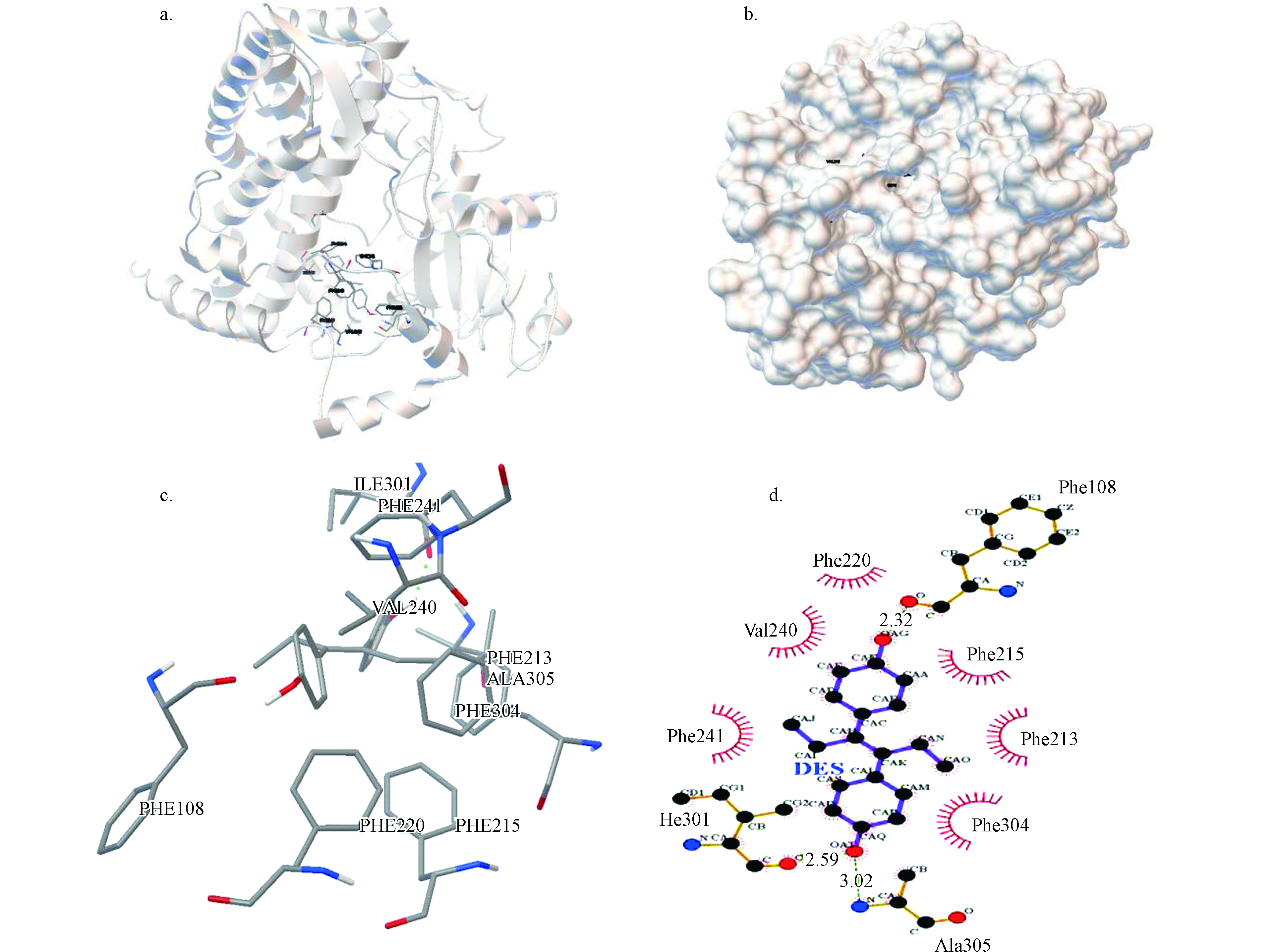
分子对接可以确定蛋白质与小分子之间的相互作用力以及确切的结合位点[15-17]。因此,通过分子对接可以从分子水平模拟CYP3A4与DES之间的相互作用。由对接结果可知,最佳构象的结合能为-7.62 kcal·mol−1。图1(a)、(b)为CYP3A4与DES的最佳结合构象图,直观地显示了DES与CYP3A4的结合位置位于CYP3A4的内部。
由图1(c)可知,小分子DES周围的氨基酸残基有PHE220、VAL240、PHE241、ILE301、ALA305、PHE304、PHE213、PHE215和PHE108。将分子对接结果导入Ligplot+软件,生成睫毛图(图1(d)),通过睫毛图能更直观地分析 DES周围的氨基酸残基及其作用力。PHE、VAL、ILE和ALA等疏水氨基酸将DES包裹其中,形成了一个很强的疏水面,具有较强的疏水作用;同时,DES与LE301、ALA305、PHE108形成氢键,加强了与CYP3A4的结合作用。氢键的详细情况见表1。由分子对接结果可知,DES与CYP3A4发生相互作用,受到很强的疏水作用力影响,且DES通过氢键作用加强了与CYP3A4的作用力,增强了配合物的稳定性。分析DES与CYP3A4的结合作用,有利于了解蛋白质大分子的二级结构的变化。
-
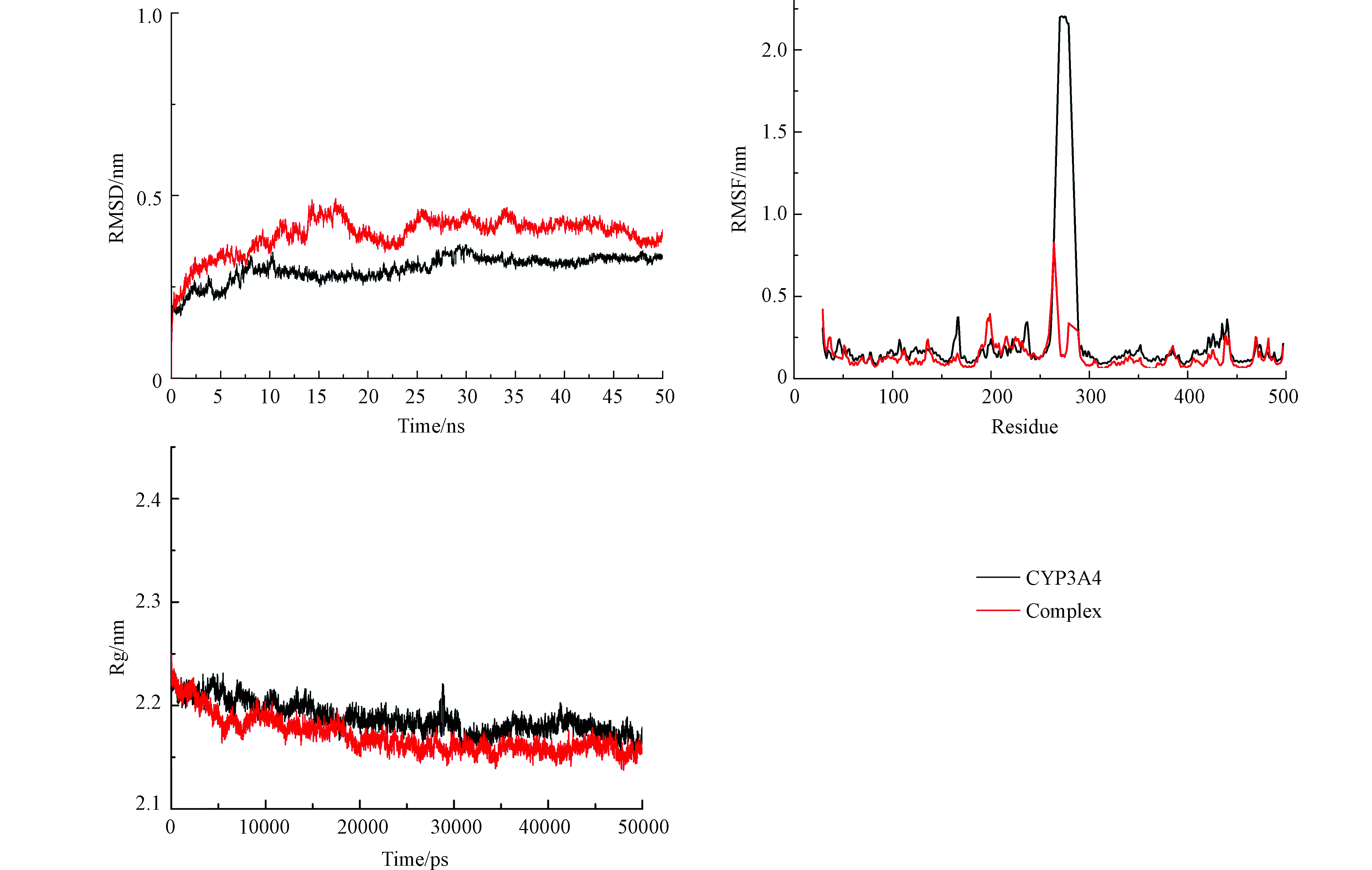
借助分子动力学模拟研究CYP3A4与DES结合时的动力学情况,利用均方根偏差(Root mean square deviation,RMSD)、均方根波动(Root mean square fluctuation,RMSF)、回旋半径(Radius of gyration,Rg)等参数来分析其结构的稳定性及其结构波动,从而判断构象的变化[18]。
RMSD是计算在某一时刻的构象与目标构象所有原子偏差的和,对原子数的平均。因此,RMSD是衡量体系是否稳定的重要依据。图2(a)中,CYP3A4与CYP3A4-DES复合物在整个模拟过程中的RMSD值变化幅度不大,都逐渐趋于平衡,表明DES能与CYP3A4形成稳定复合物,且复合物体系趋于稳定。
均方根波动(RMSF)是基于残基分析蛋白质柔性和变化情况。由图2(b)可见,CYP3A4-DES体系的RMSF值普遍小于游离CYP3A4酶的RMSF值。在氨基酸残基250—300处,游离CYP3A4酶体系和CYP3A4-DES体系的RMSF值存在较大差异,表明DES和CYP3A4结合后,形成了较稳定的复合物,使CYP3A4内部部分氨基酸残基周围微环境发生变化,进而导致CYP3A4酶的构象发生变化。
回旋半径(Rg)描述体系结构的紧凑程度[19]。图2(c)中CYP3A4-DES体系的Rg值有下降的趋势且普遍小于游离CYP3A4酶体系的Rg值,即复合物的结构更加紧密,表明复合物的二级结构在DES和CYP3A4结合后发生了变化,导致整个氨基酸螺旋结构收缩,从而致使CYP3A4的二级结构发生了变化。这些结果均表明,DES能与CYP3A4相互作用,形成稳定的中间产物。
-
在激发态下,CYP3A4酶由于含有色氨酸(TRP)、酪氨酸(TYR)和苯丙氨酸(PHE)会产生内源性荧光强度。在CYP3A4体系中添加不同量的DES,通过CYP3A4的荧光强度的变化情况来研究DES与CYP3A4之间的相互作用。如图3(a)所示,CYP3A4酶的发射光谱在使用和不使用DES状态下,在334 nm处都会有较明显的吸收峰。且随着DES浓度的增加,CYP3A4的荧光强度逐渐减小。DES改变了CYP3A4发色团周围的微环境,从而导致CYP3A4内源性荧光强度的变化。
荧光强度随配体浓度增加而降低的现象即为荧光猝灭。按照机理不同,荧光猝灭分为由蛋白质和配体碰撞导致的动态猝灭和生成非荧光络合物的静态猝灭。动态猝灭时,猝灭常数随温度的升高增大;若为静态猝灭,猝灭常数随温度升高降低[20-21]。故通过稳态荧光设备和改变温度来区分这两种机制[22]。利用Stern-Volmer方程来研究CYP3A4-DES的猝灭机理[23-27]。
其中,F0和F分别为不存在和存在猝灭剂的情况下的荧光强度,[Q]为猝灭剂浓度,Ksv为斯特恩-沃尔默淬灭常数;kq为生物分子猝灭速率常数,τ0为在没有猝灭剂的CYP3A4内源性荧光寿命(τ0=10−8 s)。利用F0/F对[Q]的线性回归图来确定CYP3A4-DES的猝灭常数。图3(b)中F0/F-[Q]有良好的线性关系。从图3(b)和表2可以直观地看出,随着温度升高,斜率越小,即Ksv越小,即温度和Ksv呈反比。且DES与CYP3A4间的猝灭速率常数kq的数量级为1018,远远大于各类猝灭剂对生物大分子的动态猝灭常数2.0×1010 L·mol−1·s−1。以上结果表明DES与CYP3A4反应已经形成非荧光络合物,其体系的猝灭机理是静态的。
-
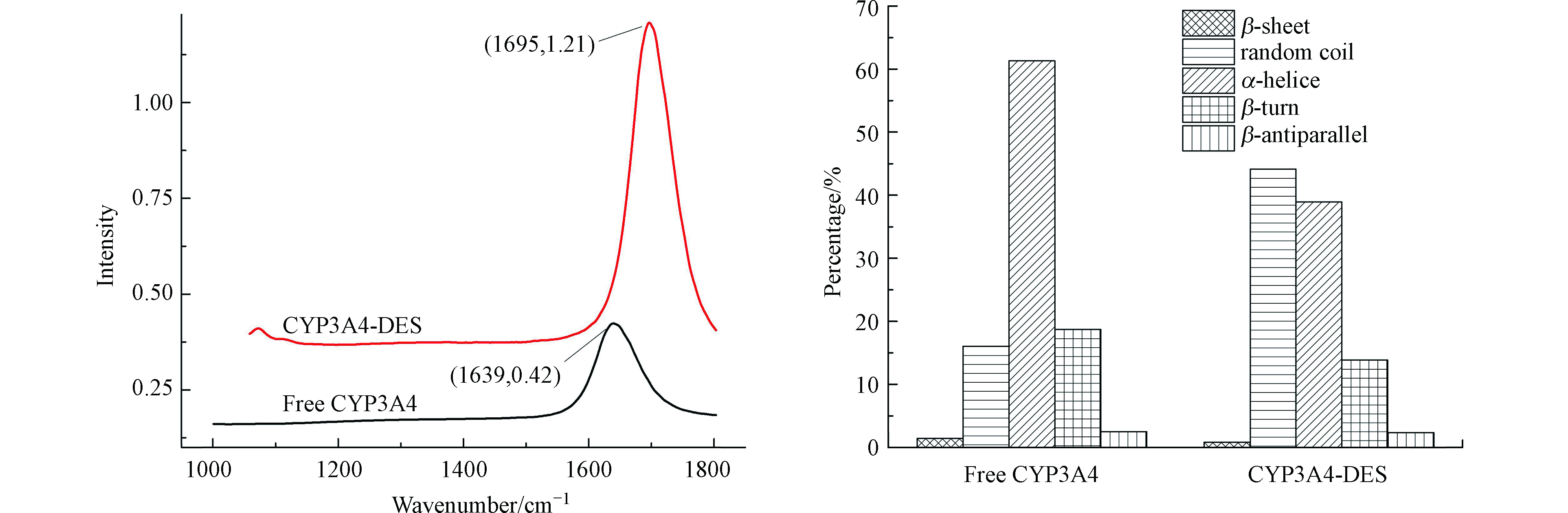
利用FT-IR光谱来分析蛋白质二级结构的变化。游离CYP3A4酶的红外光谱及CYP3A4-DES的差异红外光谱如图4(a)。游离CYP3A4酶的酰胺Ⅰ带特征吸收峰在1639 cm−1,而与DES反应后,CYP3A4的酰胺Ⅰ带特征吸收峰在1695 cm−1,且峰的强度也变强了。酰胺Ⅰ带特征峰位置及峰强度的改变表明与DES结合后,CYP3A4酶的二级结构发生变化。
由于酰胺Ⅰ带(1700—1600 cm−1)具有很高的敏感性,定量分析酰胺I带的拟合曲线,进一步计算研究蛋白质二级结构含量的变化。其中,1610—1637 cm−1、1638—1648 cm−1、1649—1660 cm−1、1661—1680 cm−1、1681—1692 cm−1,分别为β-折叠、无规则卷曲、α-螺旋、β-转角和β-反向平行[28]。拟合分析FT-IR光谱,CYP3A4酶二级结构的含量变化见图4(b)。游离CYP3A4酶由1.42%的β-折叠,16.06%的无规则卷曲,61.30%的α-螺旋,18.71%的β-转角和2.51%的β-反向平行组成。与DES结合后,CYP3A4的二级结构发生改变,无规则卷曲的含量增加到44.2%,而β-折叠、α-螺旋、β-转角和β-反向平行的含量分别降至0.82%、38.90%、13.84%和2.32%。蛋白在延伸和压缩的过程中,β-折叠和α-螺旋会发生变化,故也用β-折叠/α-螺旋的比率来说明二级结构的转变[29]。对于游离的CYP3A4酶,该值为0.023;CYP3A4与DES相互作用后的值为0.021;CYP3A4与DES生成复合物的值为0.0475。从先后变化可知,CYP3A4与DES结合,蛋白质的二级结构发生变化。
-
UV-Vis吸收光谱可用于研究蛋白质与其他分子间的相互作用及确定蛋白质构象的变化[30-32]。
在不存在和存在一定浓度DES情况下,CYP3A4的紫外可见吸收光谱如图5(a)所示。
由图5可知,随着DES浓度的增加,CYP3A4的UV-Vis吸收强度逐渐减弱,出现变色现象。这是由于CYP3A4酶与DES相互作用,改变了CYP3A4酶内环境,从而导致其紫外光谱强度发生变化。图5(b)是分别测得的游离CYP3A4酶、DES、CYP3A4-DES及其拟合光谱。复合物(Ⅲ)的吸收光谱不等于游离CYP3A4(Ⅰ)和DES(Ⅱ)吸收光谱的求和,且拟合值与实际值存在差异,该结果表明CYP3A4与DES反应后,蛋白质内部结构发生变化。综上,DES与CYP3A4相互作用,生成复合物,改变了蛋白质氨基酸残基周围的环境,引起蛋白质构象发生变化。
-
在模拟人体生理条件下,采用计算模拟和光谱法研究CYP3A4和DES相互作用机制。分子对接和动力学模拟研究表明,CYP3A4和DES间疏水作用力为主要作用力,且DES使CYP3A4结构紧缩,导致其二级结构发生变化。紫外强度的降低表明,DES和CYP3A4生成复合物,并改变了CYP3A4的构象。DES对CYP3A4具有荧光猝灭作用,猝灭机制主要是静态猝灭。红外研究表明,DES与CYP3A4结合后,CYP3A4中无规则卷曲的含量增加,β-折叠、α-螺旋、β-转角和β-反向平行的含量减少。实验研究与计算模拟结果相一致,DES与CYP3A4相互作用,生成复合物,从而改变了CYP3A4的二级结构。
结合光谱法和计算模拟分析CYP3A4酶与己烯雌酚的作用机制
Interaction between Diethylstilbestrol and CYP3A4 based on multi-spectrum methods and computational simulations
-
摘要: 本文结合分子对接、动力学模拟和光谱法,研究了己烯雌酚(Diethylstilbestrol,DES)与CYP3A4酶在模拟生理环境下(pH7.4)的相互作用机制。利用分子对接和动力学模拟方法从理论上模拟CYP3A4与DES相互作用后的构象变化情况。通过光谱法从实验角度进行验证,荧光光谱得出DES对CYP3A4的猝灭机制属于静态猝灭,红外和紫外光谱结果表明,DES与CYP3A4结合后,改变了CYP3A4的内部环境和构象。理论模拟和实验结果相互印证,为探究DES和CYP3A4的相互作用提供了重要信息和参考依据。Abstract: The interaction mechanism between Diethylstilbestrol (DES) and CYP3A4 enzyme in simulated physiological environment (pH=7.4) was studied by molecular docking, kinetic simulation and spectrometric method. The molecular docking and dynamics simulation were used to simulate the conformation changes of CYP3A4 and DES in theory. Then, it was experimental verified by spectral methods. The fluorescence spectra showed that the quenching mechanism of CYP3A4 by DES was static quenching. The results of IR and UV spectra showed that the internal environment and conformation of CYP3A4 were changed after DES interacted with CYP3A4. The theoretical simulation and experimental results were consistent with each other, which provides important information and reference for exploring the interaction between DES and CYP3A4.
-
Key words:
- CYP3A4 /
- diethylstilbestrol /
- multi-spectrum methods /
- computational simulation
-

-
图 5 (a)含有不同浓度DES的CYP3A4体系的UV吸收光谱;(b)在λ190—450 nm范围内的紫外吸收光谱。实线表示CYP3A4酶(Ⅰ,黑色)、DES(Ⅱ,红色)和CYP3A4-DES复合物(1∶1)(Ⅲ,蓝色)的UV光谱。虚线表示每个光谱的理论吸光度。
Figure 5. (a) UV absorption spectra of CYP3A4 system with different concentrations of DES (b) UV absorption spectra in range of λ190—450 nm. The solid lines represent the UV spectra of the CYP3A4 (Ⅰ,black), DES (Ⅱ,red) and the CYP3A4-DES complex (1∶1) (Ⅲ,blue). The dotted lines represent the theoretical absorbance of each spectra.
表 1 CYP3A4与DES氢键作用力
Table 1. Hyrrogen Bond between CYP3A4 and DES
氨基酸残基Amino acid residues 作用原子Atom 键长/nm Bond length ILE301 O—O 0.259 ALA305 N—O 0.302 PHE108 O—O 0.232 表 2 CYP3A4和DES在不同温度下相互作用的猝灭常数(Ksv),生物猝灭速率常数(kq)
Table 2. Quenching constant and biomolecule quenching rate constant of the interaction between CYP3A4 and DES at different temperatures.
温度Temperature/K Ksv(×108 )/(L·mol−1) kq(×1018)/( L·mol−1·s−1) 290 8.77 8.77 300 4.05 4.05 310 2.11 2.11 -
[1] SHAIK S, FILATOV M, SCHRDER D, et al. Electronic structure makes a difference: Cytochrome P-450 mediated hydroxylations of hydrocarbons as a two-state reactivity paradigm [J]. Chemistry A European Journal, 2010, 4(2): 193-199. [2] MEUNIER B, VISSER S P D, SHAIK S. Mechanism of oxidation reactions catalyzed by cytochrome P450 enzyme [J]. Cheminform, 2004, 104(9): 3947-3980. [3] KOONG L Y, WASTON C S. Direct estradiol and diethylstilbestrol actions on early-versus late-stage prostate cancer cells [J]. The Prostate, 2014, 74(16): 1589-1603. doi: 10.1002/pros.22875 [4] GABIZON, ALBERTO. Diethylstilbestrol for the treatment of patients with castration-resistant prostate cancer: Retrospective analysis of a single institution experience [J]. Oncology Reports, 2014, 31(1): 428-34. doi: 10.3892/or.2013.2852 [5] STEFANICK M L. Estrogens and progestins: Background and history, trends in use, and guidelines and regimens approved by the US Food and drug Administration [J]. American Journal of Medicine, 2005, 118(12): 64-73. doi: 10.1016/j.amjmed.2005.09.059 [6] YIN Y, LIN C X, MA L. Msx2 promotes vaginal epithelial differentiation and wolffian duct regression and dampens the vaginal response to diethylstilbestrol [J]. Molecular Endocrinology, 2006, 20(7): 1535-1546. doi: 10.1210/me.2005-0451 [7] 端正花, 朱琳, 宫知远, 等. 己烯雌酚在斑马鱼胚胎中的生物蓄积及毒性机制研究 [J]. 环境科学, 2009, 30(2): 522-526. doi: 10.3321/j.issn:0250-3301.2009.02.036 DUAN Z H, ZHU L, GONG Z Y, et al. Bioaccumulation and toxicity test of diethylstilbestrol to zebrafish (danio rerio) embryo [J]. Environmental Science, 2009, 30(2): 522-526(in Chinese). doi: 10.3321/j.issn:0250-3301.2009.02.036
[8] HE S H, LIANG Z H, ZHAN W, et al. Establishment of the recombinant yeast assay system for environmental estrogens [J]. Journal of Environment & Health, 2002, 19(1): 57-59. [9] 蒋义国, 陈家坤. 己烯雌酚对乌拉坦诱发小鼠肺肿瘤的促进作用 [J]. 癌变. 畸变. 突变, 1998, 10(2): 72-75. JIANG Y G, CHEN J K. Effect of diethylstilbestrol on urethan-induced lung tumorigenesis in kunming mice [J]. Carcinogenesis Teratogenesis and Mutagenesis, 1998, 10(2): 72-75(in Chinese).
[10] 黄芬, 叶绍辉, 龚振明. 己烯雌酚的研究进展 [J]. 中国畜牧兽医, 2007, 34(2): 52-55. HUANG F, YE S H, GONG Z M. The development of diethylstilbestrol [J]. China Animal Husbandry & Veterinary Medicine, 2007, 34(2): 52-55(in Chinese).
[11] HU Q, GUAN X Q, SONG L L, et al. Inhibition of pancreatic lipase by environmental xenoestrogens [J]. Ecotoxicology and Environmental Safety, 2020, 192: 110305. doi: 10.1016/j.ecoenv.2020.110305 [12] 刘红艳, 谢世伟, 唐琳, 等. 基于计算模拟与响应面分析漆酶对己烯雌酚的降解作用 [J]. 环境科学学报, 2020, 40(4): 1174-1184. LIU H Y, XIE S W, TANG L, et al. Degradation of diethylstilbestrol by laccase based on computational simulation and response surface analysis [J]. Acta Scientiae Circumstantiae, 2020, 40(4): 1174-1184(in Chinese).
[13] WEI Y, YI Z S, XU J, et al. Study on the binding characteristics of hydroxylated polybrominated diphenyl ethers and thyroid transporters using the multispectral technique and computational simulation [J]. Journal of Biomolecular Structure & Dynamics, 2018, 37(6): 1402-1413. [14] TANG B, TANG P X, HE J W, et al. Characterization of the binding of a novel antitumor drug ibrutinib with human serum albumin: Insights from spectroscopic, calorimetric and docking studies. [J]. Journal of Photochemistry and Photobiology. B, Biology, 2018, 184: 18-26. doi: 10.1016/j.jphotobiol.2018.05.008 [15] MORRIS G M, HUEY R, LINDSTROM W, et al. AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility [J]. Journal of Computational Chemistry, 2010, 30(16): 2785-2791. [16] NASROLLAH R G, AZADEN E H, ALI M M, et al. Effect of polyamines on the structure, thermal stability and 2, 2, 2-trifluoroethanol-induced aggregation of alpha-chymotrypsin. [J]. International Journal of Biological Macromolecules, 2007, 41(5): 597-604. doi: 10.1016/j.ijbiomac.2007.07.018 [17] SADEGH F, BEHZAD S, ALI A S, et al. The influence of putrescine on the structure, enzyme activity and stability of α-chymotrypsin [J]. RSC Advances, 2016, 6(35): 29264-29278. doi: 10.1039/C5RA25053F [18] 董露, 易忠胜, 伍智蔚, 等. 结合光谱法和计算模拟多角度分析2, 2′, 4, 4′, 5-五溴二苯醚与人血清白蛋白的作用机制 [J]. 环境科学学报, 2016, 36(1): 332-339. DONG L, YI Z S, WU Z W, et al. Interaction between 2, 2', 4, 4', 5-pentabromodiphenyl ether and human serum albumin based on multi-spectroscopic and computational simulations [J]. Acta Scientiae Circumstantiae, 2016, 36(1): 332-339(in Chinese).
[19] 李志娟, 韦明奉, 韦勇, 等. 分子荧光光谱法结合分子动力学模拟研究2'-OH-BDE-68与HSA的相互作用 [J]. 理化检验-化学分册, 2017, 53(1): 6-11. LI Z J, WEI M F, WEI Y, et al. Study on the interaction between 2'-OH-BDE-68 and HAS by molecular fluorospectrometry and molecular dynamics simulation [J]. Physical Testing and Chemical Analysis Part B:Chemical Analysis, 2017, 53(1): 6-11(in Chinese).
[20] 孙梅香, 刘文, 高嘉苓, 等. 荧光光谱法研究草甘膦与腐殖酸的相互作用 [J]. 环境化学, 2015, 34(8): 1529-1534. doi: 10.7524/j.issn.0254-6108.2015.08.2014122401 SUN M X, LIU W, GAO J L, et al. Study on the interaction between glyphosate and humic acid using fluorescence spectrometry and parallel factor analysis method [J]. Environmental Chemistry, 2015, 34(8): 1529-1534(in Chinese). doi: 10.7524/j.issn.0254-6108.2015.08.2014122401
[21] 梁彦秋, 邓斌, 刘婷婷, 等. 4-硝基苯胺与人血清白蛋白相互作用的研究 [J]. 环境化学, 2007, 26(6): 845-849. doi: 10.3321/j.issn:0254-6108.2007.06.027 LIANG Y Q, DENG B, LIU T T, et al. Investigation on interaction of 4-nitroaniline with human serum albumin [J]. Environmental Chemistry, 2007, 26(6): 845-849(in Chinese). doi: 10.3321/j.issn:0254-6108.2007.06.027
[22] NAYARA S D A C, CARO P C, DANIEL P B, et al. An investigation into the interaction between piplartine (piperlongumine) and human serum albumin [J]. Spectrochimica Acta Part A Molecular and Biomolecular Spectroscopy, 2019, 220: 117084. [23] VERLAG S. Principles of fluorescence spectroscopy [J]. Die Naturwissenschaften, 2006, 78(10): 456. [24] CARUSO I P, FILHO J M B, ARAUJO A S D, et al. An integrated approach with experimental and computational tools outlining the cooperative binding between 2-phenylchromone and human serum albumin [J]. Food Chemistry, 2016, 196: 935-942. doi: 10.1016/j.foodchem.2015.10.027 [25] CARUSO, I P, VILEGAS W, DE S F P, et al. Binding of antioxidant flavone isovitexin to human serum albumin investigated by experimental and computational assays [J]. Journal of Pharmaceutical & Biomedical Analysis, 2014, 98: 100-106. [26] YUE Y Y, ZHAO S F, SUN Y Y, et al. Effects of plant extract aurantio-obtusin on pepsin structure: Spectroscopic characterization and docking simulation [J]. Journal of Luminescence, 2017, 187: 333-339. doi: 10.1016/j.jlumin.2017.03.041 [27] CAMARGO C R, CARUSO I P, GUTIERREZ S J C, et al. Spectral and computational features of the binding between riparins and human serum albumin [J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 190: 81-88. doi: 10.1016/j.saa.2017.08.068 [28] MANOUCHEHRI F, IZADMANESH Y, AGHAEE E, et al. Experimental, computational and chemometrics studies of BSA-vitamin B6 interaction by UV–Vis, FT-IR, fluorescence spectroscopy, molecular dynamics simulation and hard-soft modeling methods [J]. Bioorganic Chemistry, 2016, 68(Complete): 124-136. [29] LITVINOV R, FAIZULLIN D, ZUEV Y, et al. The α-helix to β-sheet transition in stretched and compressed hydrated fibrin clots [J]. Biophysical Journal, 2012, 103(5): 1020-1027. doi: 10.1016/j.bpj.2012.07.046 [30] MOZHGAN M, BEHZAD S, ALI A S, et al. Comparative studies on the interaction of spermidine with bovine trypsin by multispectroscopic and docking methods [J]. Journal of Physical Chemistry B Condensed Matter Materials Surfaces Interfaces & Biophysical, 2016, 120(36): 9632-41. [31] SIDDIQI M K, ALAM P, CHATURVEDI S K, et al. Probing the interaction of cephalosporin antibiotic–ceftazidime with human serum albumin: A biophysical investigation [J]. International Journal of Biological Macromolecules, 2017, 105(1): 292-299. [32] ALAM P, CHATURVEDI S K, ANWAR T, et al. Biophysical and molecular docking insight into the interaction of cytosine β-D arabinofuranoside with human serum albumin [J]. Journal of Luminescence, 2015, 164: 123-130. doi: 10.1016/j.jlumin.2015.03.011 -



 下载:
下载: