-
四环素类抗生素价格低、抑菌效果好、副作用小,被广泛用于治疗和预防人畜疾病,以及用作畜禽生长促进剂和饲料[1-3]。但其进入生物体内后仅少部分被吸收利用,大部分随粪便、尿液等排出体外[4],最终积累到自然水体中。现有废水处理过程不能完全去除抗生素[5],这对地表和地下水源构成潜在危害,对人体健康和整个生态环境也造成巨大影响[6-7]。
抗生素进入水环境后,会在物理、化学、生物等综合作用下发生降解转化,如四环素类抗生素具有光不稳定性,遇光易分解,光降解是其在自然条件下去除的主要途径之一[8-10]。纳米材料,如二氧化钛体积小、表面积大,具有光催化性能,可与周围化合物进行相互作用[11-13]。因此,当纳米TiO2与抗生素在水环境中共存时,可能对抗生素的迁移转化,尤其是光降解行为产生影响[14]。QI等[15]研究表明,水体中的四环素吸附到纳米TiO2表面后,使纳米TiO2零电荷点增大,更容易在水体中团聚,从而导致四环素在环境中的迁移效率下降。VARMA等[16]发现带隙为3.15 eV的TiO2纳米材料,在LED灯模拟可见光照射条件下,6 h内将50 mg·L−1左氧氟沙星的光降解效率提高了83%。
因此,本研究选择土霉素(oxytetracycline, OTC)、金霉素(chlorotetracycline, CTC)作为目标物质,考察纳米TiO2对OTC、CTC光降解效能影响,探究纳米TiO2暴露下OTC、CTC光降解机理,并研究纳米TiO2暴露下OTC、CTC光降解过程水质急性毒性和遗传毒性变化规律。
-
实验材料:纳米二氧化钛(TiO2,99.3%)、盐酸土霉素(C22H24N2O9·HCl,AR 95%)、盐酸金霉素(C22H23ClN2O8·HCl,AR 95%)、盐酸(HCl,36%~38%)、氢氧化钠(NaOH,AR 97%)、氯化钠(NaCl,AR 97%)、碳酸钠(Na2CO3,AR 97%)、草酸钠(Na2C2O4,AR 97%)、抗坏血酸(VC,AR 97%)、无水乙醇(C2H5OH,HPLC ≥99.9%)、异丙醇(C3H8O,HPLC ≥99.9%),实验室用水为超纯水。
实验仪器:紫外可见分光光度计(Thermo evolution 300,赛默飞科技有限公司)、X射线能谱仪(ESCALAB 1600,赛默飞科技有限公司)、数控超声波清洗仪(KQ-300DE,昆山超声仪器有限公司)、光化学反应器(CEL-HXF300,北京中交金源有限公司)。
-
在石英光反应管中加入100 mL 10 mg·L−1 OTC、CTC溶液,用NaOH和HCl溶液调节体系pH后加入一定量纳米TiO2,暗反应30 min,打开光源,每60 min取样1次,利用紫外-可见分光光度计测量样品中OTC(353 nm)、CTC(365 nm)残留质量浓度。分别考察纳米TiO2投加量(0~50 mg·L−1)、粒径(5~100 nm)、暴露时间(0~360 min)、pH(3.0~11.0)和共存阴离子(HCO3−、Cl−)等因素的影响。每组实验重复3次,计算平均值及标准误差。
-
采用X射线衍射(X-ray diffraction, XRD)分析纳米TiO2晶相组成;采用扫描电子显微镜(scanning electron microscope, SEM)表征纳米TiO2表面形貌变化;采用比表面积测试法(Brunauer Emmett Teller, BET)测定纳米TiO2比表面积及孔隙结构。
光降解活性物种鉴定。采用电子顺磁共振波谱仪(electron spin resonance spectroscopy, ESR)测定体系中的光降解活性物种。再采用淬灭实验,向体系中分别加入一定量异丙醇(iso-Propyl alcohol, IPA)、抗坏血酸(Vitamin C, VC)和草酸钠(Na2C2O4)溶液以捕获羟基自由基(·OH)、超氧自由基(·O2−)和光生空穴(h+),其他过程同1.2节所述,利用式(1)~(3)计算各活性基团对OTC、CTC光降解的贡献率R。
式中:R为光降解贡献率,%;K为降解速率常数,min−1。
-
通过小球藻生长抑制实验检测水质急性毒性。将小球藻藻种连续培养至对数生长期后进行实验,设阴性对照组(仅有BG-11培养基)、空白对照组(仅10 mg·L−1抗生素或仅50 mg·L−1 20~40 nm TiO2)和实验组(50 mg·L−1 20~40 nm TiO2与10 mg·L−1抗生素分别反应0、60、180、300和360 min),实验周期7 d,每天定时取样1次,通过紫外-可见分光光度计在680 nm测定细胞悬浮液光密度以监控小球藻的生长状况,并利用式(4)~(5)计算小球藻生长抑制率。
式中:N为藻类细胞生长量;N1为起始时刻细胞数;Nn为最终时刻细胞数;μ为藻类平均生长率,细胞·d−1;μc为阴性对照组平均生长速率,细胞·d−1;μt为处理组平均生长速率,细胞·d−1;t为培养时间,d;t1为起始时间,d;tn为终止时间,d;i为藻类生长抑制率,细胞·d−1。
通过蚕豆根尖微核实验检测体系水质遗传毒性。经蚕豆染毒处理、根尖解离、染色制片、镜检等步骤后,由蚕豆根尖细胞微核率和微核指数衡量水质遗传毒性大小。根据式(6)~(7)分别计算每组样本千分微核率(MCN)及微核指数(MCI)。通常情况下,MCI大于1.5代表该染毒实验组相比阴性对照组表现为致突变性。
式中:P为千分微核率;Nm为微核细胞数;Nc为细胞总数;Pi为每组样本的千分微核率;PNC为阴性对照组的千分微核率;I为微核指数。
-
1)纳米TiO2投加量对OTC、CTC光降解效能影响。在OTC、CTC初始质量浓度为10 mg·L−1、pH为6.0条件下,考察纳米TiO2投加量(0~50 mg·L−1、粒径20~40 nm)对OTC、CTC光降解效率的影响,结果如图1所示。可以看出,OTC、CTC的光降解效率随纳米TiO2投加量的增加逐渐提高,当纳米TiO2投加量为1.0 mg·L−1时,OTC、CTC的光降解率分别为19.73%、15.78%,与未投加纳米TiO2体系的光降解效率相近;当纳米TiO2投加量为50.0 mg·L−1时,OTC、CTC的光降解率最大分别为69.32%和66.92%。如图1(b)、图1(d)所示,纳米TiO2暴露下OTC、CTC光降解符合准一级反应动力学,呈良好线性关系,拟合系数大于0.997,说明在本研究质量浓度范围内,增大纳米TiO2投加量能有效提升OTC、CTC光降解效能,这是因为纳米TiO2具有光催化性,增大投加量可增大其与OTC、CTC接触碰撞概率,增加其对光的吸收,导致溶液中产生的活性自由基增多,促进OTC、CTC光降解。
2)纳米TiO2粒径对OTC、CTC光降解效能影响。在OTC、CTC初始质量浓度为10 mg·L−1、纳米TiO2投加量为50 mg·L−1、pH为6.0条件下,考察纳米TiO2粒径(5~100 nm)对OTC、CTC光降解效率的影响,结果如图2所示。可以看出,不同粒径纳米TiO2对OTC、CTC光降解效率的影响有显著差异,呈现纳米TiO2粒径减小光降解速率及效率升高的趋势。TiO2粒径为100 nm的体系对OTC、CTC光降解过程促进作用有限,相比于未投加纳米TiO2的体系,光降解效率仅提高不到20%;而粒径为5~10和20~40 nm的体系对OTC、CTC光降解有明显促进作用,5~10 nm TiO2在暴露360 min后对OTC、CTC的光降解率可达到95.93%、97.13%,且反应速率较快,前60 min OTC、CTC降解率达到60%以上。
一方面,可能是因为粒径影响纳米TiO2在水中的分散性,相同质量浓度下,较小粒径的纳米颗粒分散性更好,光透过率较大,更有利于纳米TiO2颗粒对光的吸收与利用;另一方面,粒径影响纳米TiO2的比表面积,相同质量浓度下,小粒径的颗粒比表面积更大,单位面积上活性位点及可吸附的抗生素分子更多,因此,有利于二者接触反应,提高光反应发生概率,促进OTC、CTC光降解。此外,有研究[17]表明,当材料粒径在1~10 nm时,量子尺寸效应增强,导带和价带成为独立的能级,能隙变宽,生成光生电子和空穴的能量更高,氧化还原能力更大,光催化活性提高。
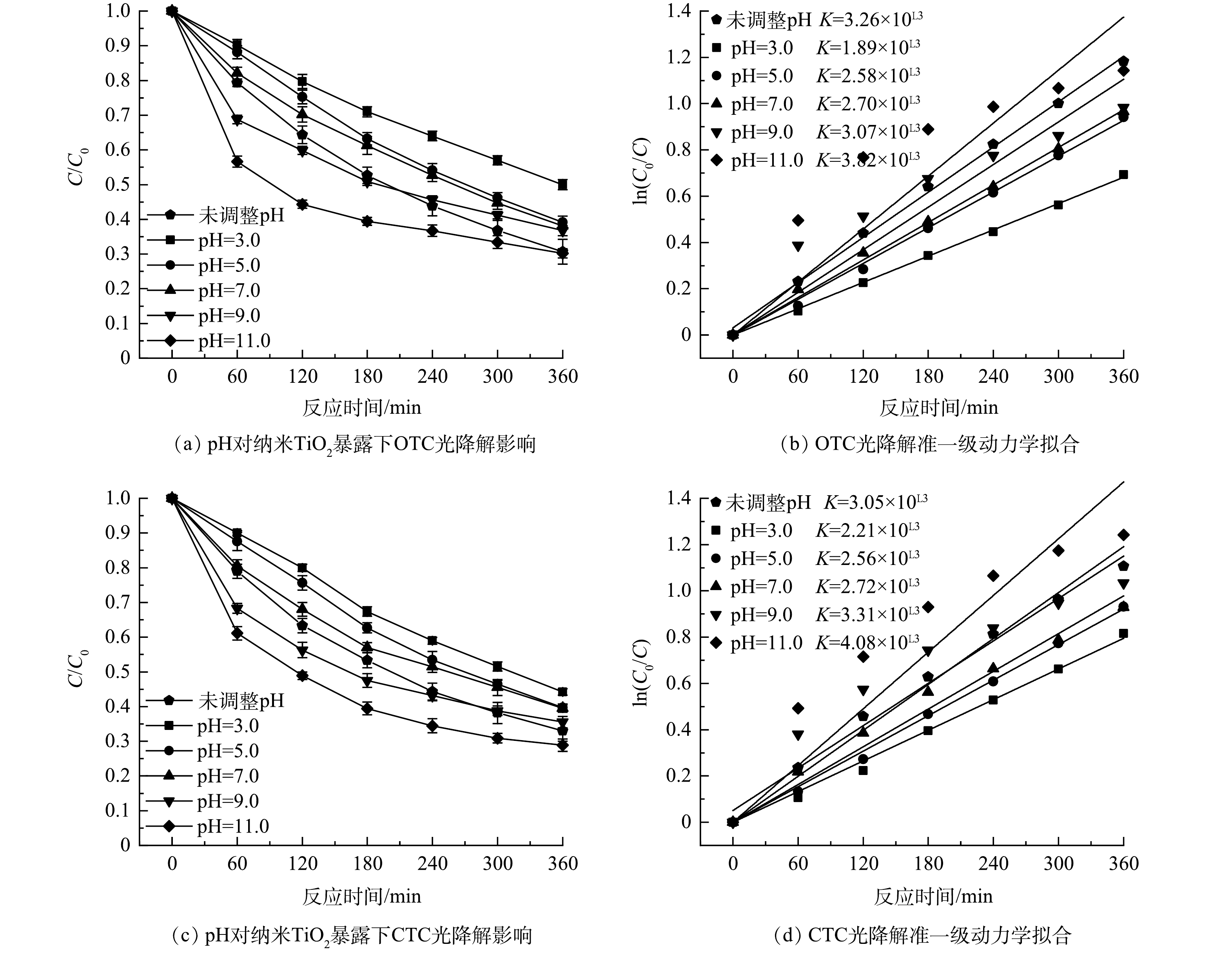
3)初始pH对纳米TiO2暴露下OTC、CTC光降解效能影响。在OTC、CTC初始质量浓度10 mg·L−1、纳米TiO2投加量50 mg·L−1、粒径20~40 nm条件下,考察不同初始pH(3.0~11.0)对OTC、CTC光降解效率的影响,结果如图3所示。可以看出,随着体系初始pH升高,OTC、CTC的光降解效率逐渐增加,光降解速率增大。当pH为3.0时,OTC、CTC光降解率分别为49.76%和55.79%;当pH为5.0时,光降解效率上升到58.89%、59.62%,与pH为7.0时光降解效率相近;未调整pH体系中,OTC、CTC的pH分别为7.58和7.31,光降解率分别为69.32%和66.92%,介于pH为7.0和9.0体系之间;随着体系初始pH继续升高到11.0,OTC、CTC在光照180 min后就有超过60%的降解率,光照360 min后光降解效率最大,达到69.10%、71.11%。
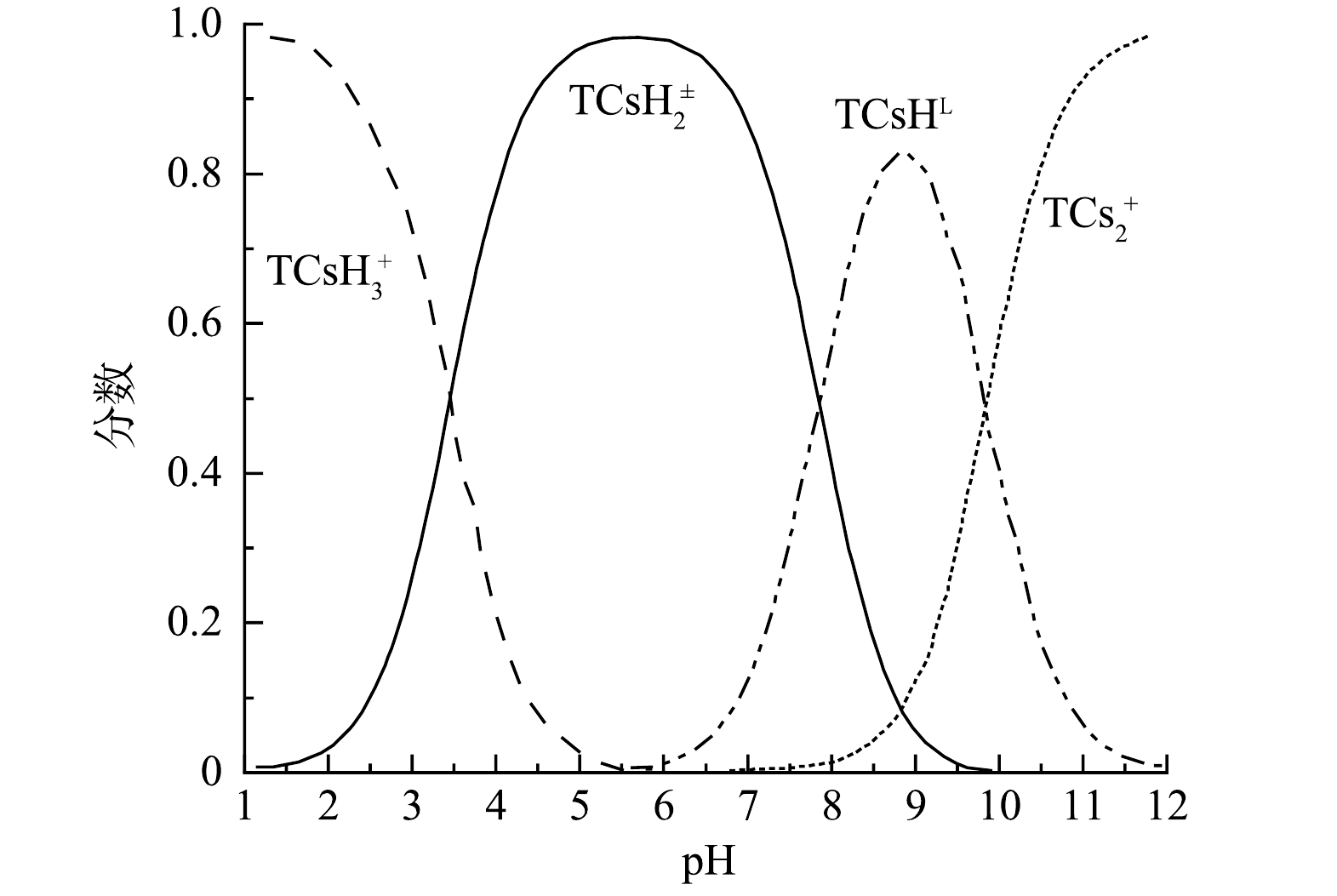
OTC和CTC在溶液中的形态会随着溶液pH的变化而变化。由图4所知,在强酸性条件下OTC、CTC为阳离子形态,弱酸性条件下为两性离子形态,弱碱性条件下为阴离子形态,强碱性条件下为双阴离子形态。不同离子形态的OTC、CTC发生光降解时所需的光能不同,阳离子形态所需要的光能更高,阴离子形态所需的光能较低,故随着溶液pH的升高,OTC、CTC更容易发生光降解。这与赵雪辉[18]的研究结果一致。此外,虽然纳米TiO2是两性氧化物,在中性和偏碱性条件下表面带负电荷,与OTC、CTC产生静电排斥作用会导致光降解效率有一定的下降,但因为在本研究的浓度范围内,pH对OTC、CTC的影响较大,静电排斥作用可忽略,故光降解效率仍呈现随溶液pH的升高而增大的趋势。
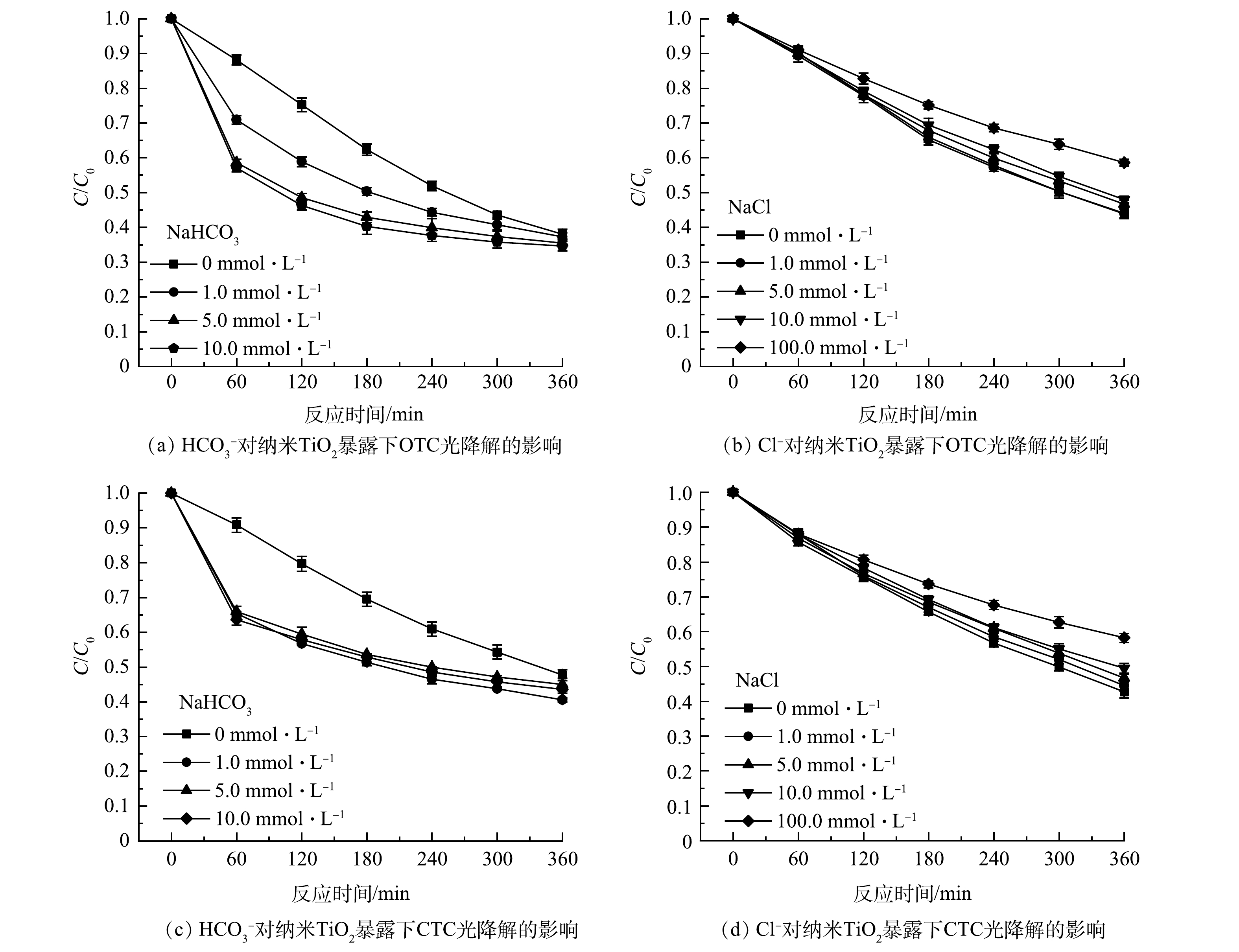
4)共存阴离子对纳米TiO2暴露下OTC、CTC光降解效能影响。在OTC、CTC初始质量浓度为10 mg·L−1、纳米TiO2投加量为50 mg·L−1、粒径20~40 nm条件下,考察共存阴离子对OTC、CTC光降解效率的影响,结果如图5所示。可以看出,溶液中HCO3−对OTC、CTC的光降解有一定的促进作用,光降解速率较无HCO3−存在体系有所加快,但360 min后光降解效率没有明显增大;而Cl−对OTC、CTC的光降解过程有较明显的抑制作用,在100.0 mmol·L−1 Cl−存在体系中,OTC、CTC光降解效率降低了14.73%、14.91%,且抑制作用与离子浓度呈正相关,随离子浓度的增大而增大。这一结果与张亚宣[19]研究共存离子对四环素光降解影响的结果一致。
HCO3−促进OTC、CTC光降解的原因可能是,有HCO3−存在的体系中,溶液pH在6.0~9.0之间,而2.1节(3)中证实溶液偏碱性时OTC、CTC光降解更快;Cl−抑制OTC、CTC光降解可能是由于Cl−较OTC、CTC而言,更易捕获溶液中的光生电子或被溶液中的光生空穴氧化,因此减少了溶液中的活性基团,从而降低了OTC、CTC的光降解效率[20]。
-
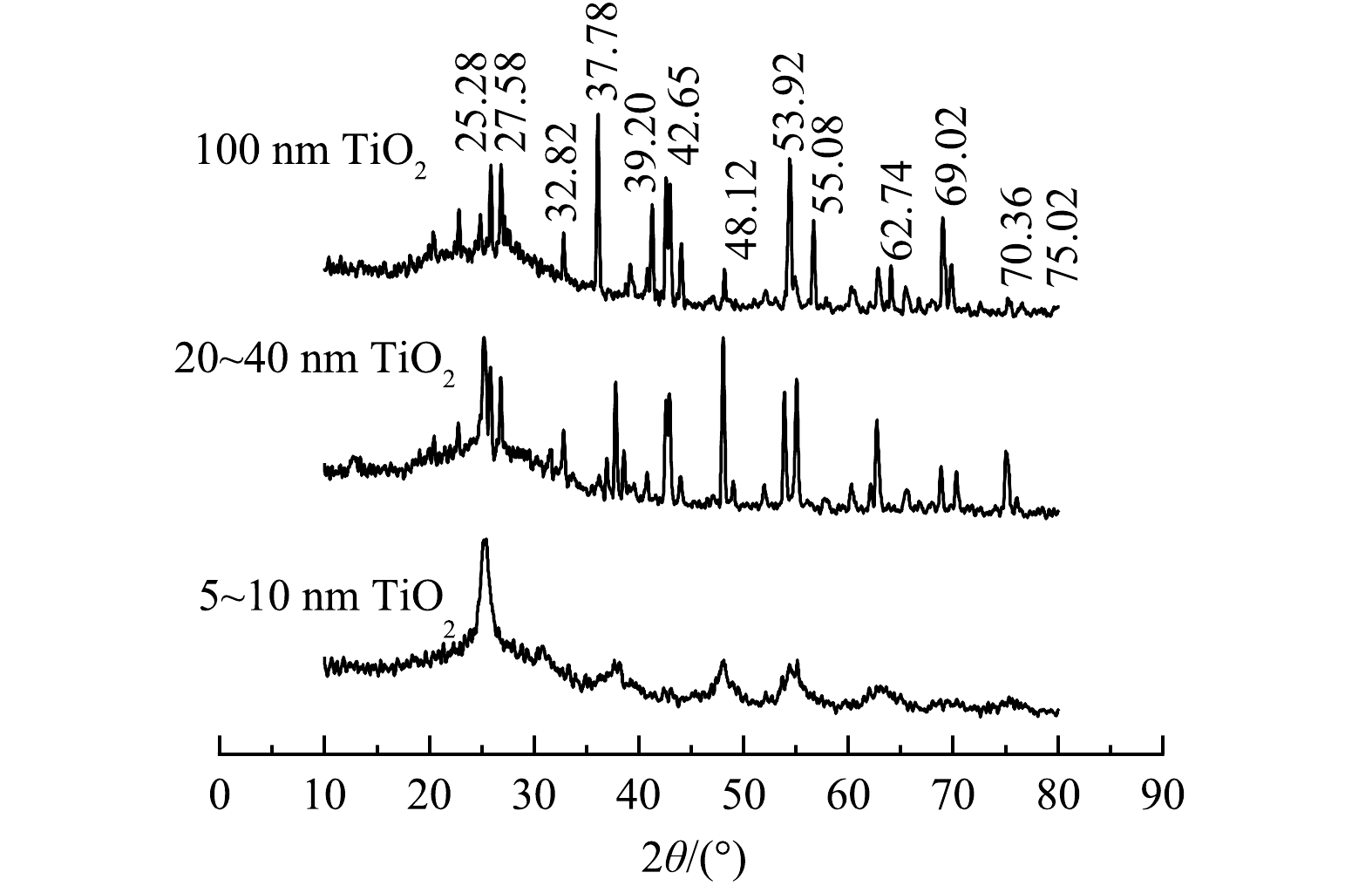
1) XRD测定。纳米TiO2材料的XRD谱图如图6所示。可以看出,37.78°、48.12°、53.92°和55.08°处的峰非常明显,且峰形尖锐,这证实了纳米TiO2材料具有良好的结晶度。图6中25.28°、37.78°、39.20°、48.12°、53.92°、62.74°、69.02°和75.02°处的尖峰可归因于锐钛矿型TiO2;而27.58°、32.82°、42.65°、55.08°和70.36°处的尖峰则归因于金红石型TiO2的衍射峰[21]。从以上数据可以看出,实验所用的纳米TiO2材料既有锐钛矿型又有金红石型,具有较好的结晶性,但随着粒径的增大,材料的XRD谱图出现一些杂峰,从而影响了纳米TiO2的性能,降低了其对OTC、CTC光降解的促进作用,与2.1节(2)的实验结果一致。
2) SEM测定。图7为纳米TiO2的扫描电镜(SEM)图。通过比较可以发现,5~10 nm和20~40 nm的TiO2分散性好、形态相对均匀,颗粒呈球型,而100 nm的TiO2粒径分布不均匀,有少数颗粒直径大于100 nm,且形状不规则,导致其比表面积较小。因此,该粒径尺寸下的纳米TiO2在OTC、CTC光降解过程中促进作用较小,与2.1节(2)的结论是一致。
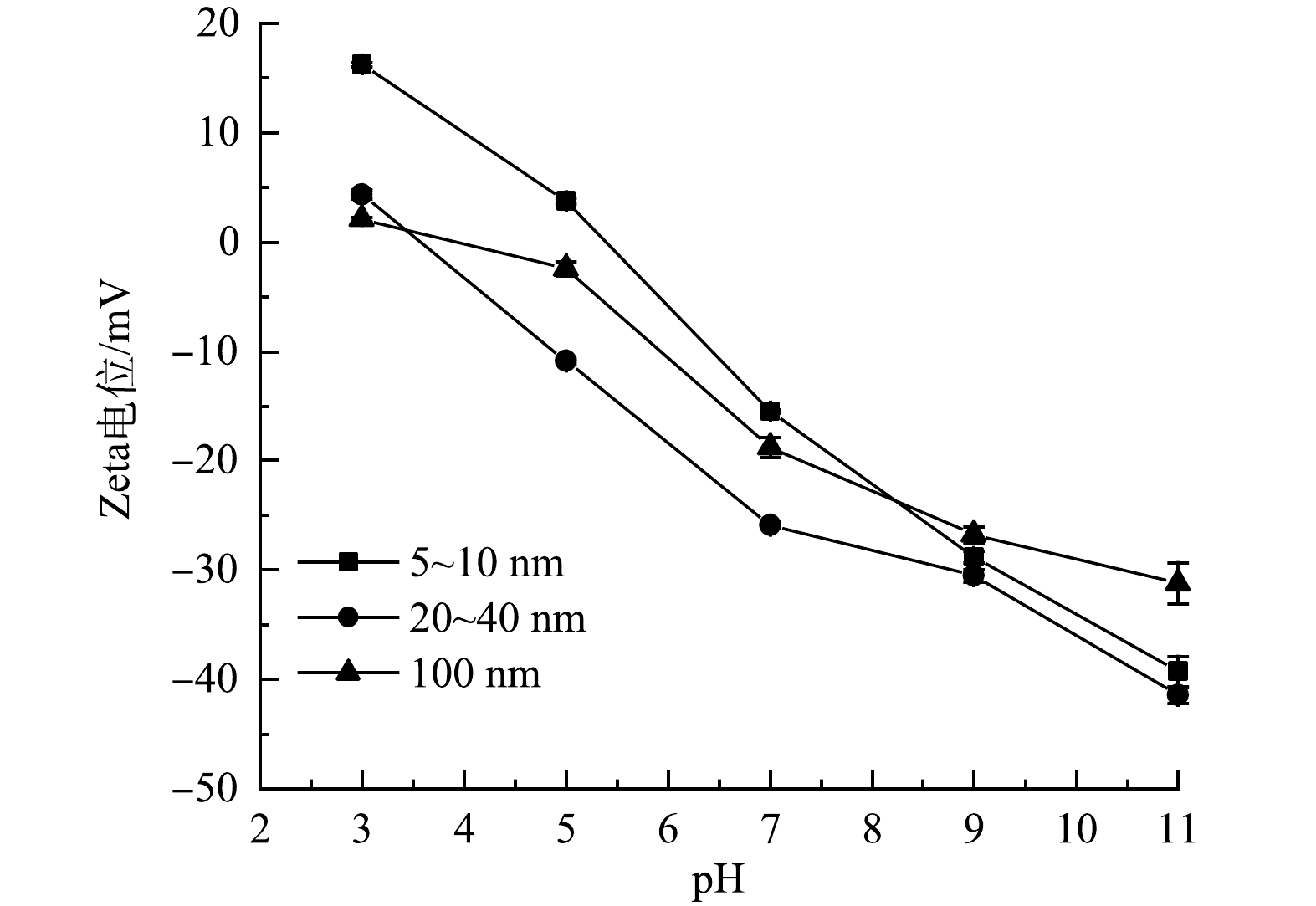
3) Zeta电位测定。不同pH条件下,不同粒径纳米TiO2的Zeta电位如图8所示。在pH 3~11内,纳米TiO2的Zeta电位随着pH的增大而升高(绝对值变大),5~10 nm TiO2的等电点约为pH=5.2,20~40 nm和100 nm TiO2的等电点相近,分别为pH=3.2和pH=3.6。结合2.1节(3)可知,随着pH的增大,OTC、CTC和纳米TiO2表面均带负电荷,会产生静电排斥作用,减少纳米TiO2对污染物的吸附作用。
4) BET测定。随纳米颗粒粒径增大,比表面积逐渐减小,5~10 nm TiO2比表面积为215.61 m2·g−1,20~40 nm TiO2比表面积为52.46 m2·g−1,100 nm TiO2比表面积为16.49 m2·g−1,仅为5~10 nm TiO2的7.7%。因此,粒径较小的纳米TiO2可能会存在更多的反应活性位点,在OTC、CTC光降解过程中能够吸附更多的抗生素分子,对光降解过程的促进作用更加明显。
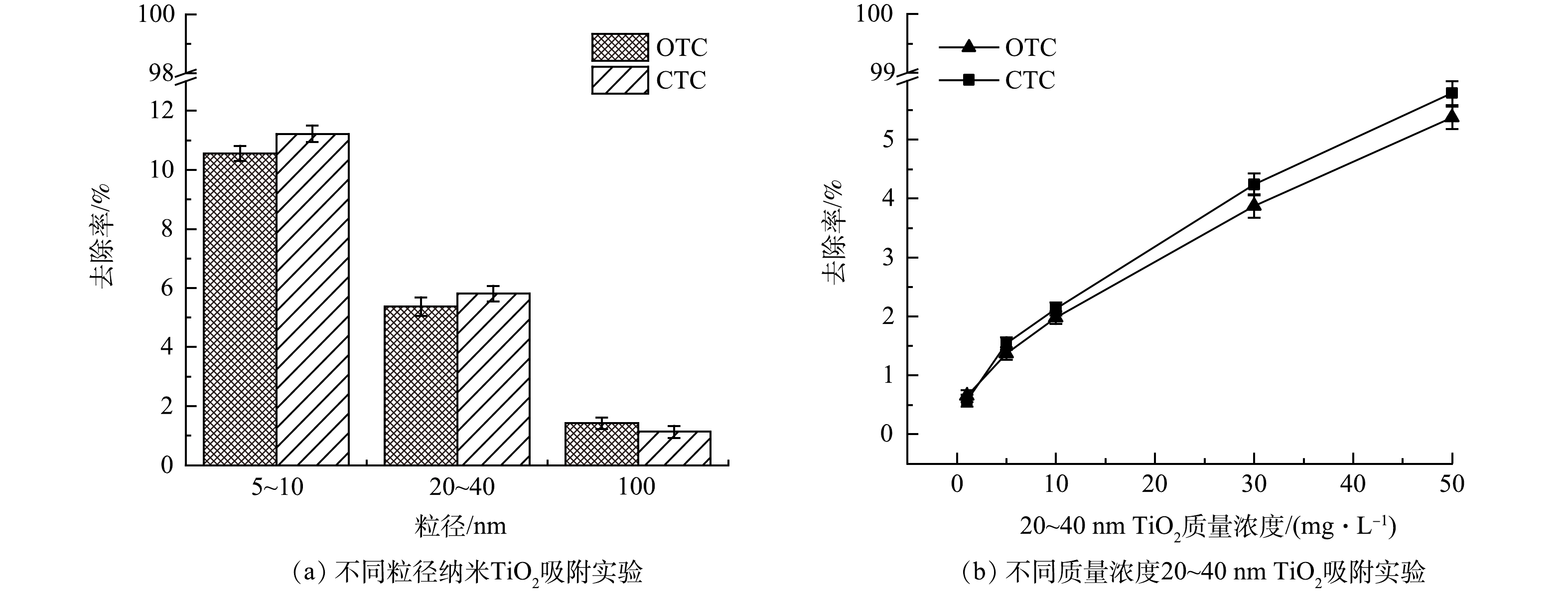
为进一步明确纳米TiO2暴露下OTC、CTC的去除途径,设计吸附实验与光降解实验进行对比,结果如图9所示。在相同反应条件下,不同粒径纳米TiO2的吸附实验结果表明,在反应360 min后,5~10 nm TiO2对OTC、CTC的吸附去除率分别为10.56%、11.22%,20~40 nm TiO2对其吸附去除率分别为5.37%、5.81%,100 nm TiO2对其吸附去除率分别为1.42%、1.13%。不同质量浓度20~40 nm纳米TiO2吸附实验结果表明,随投加量的增大,纳米TiO2对OTC、CTC的吸附去除率增大,但不超过光降解效率的10%,表明OTC、CTC去除的主要机制是纳米TiO2促进光降解反应,而非纳米TiO2的吸附。
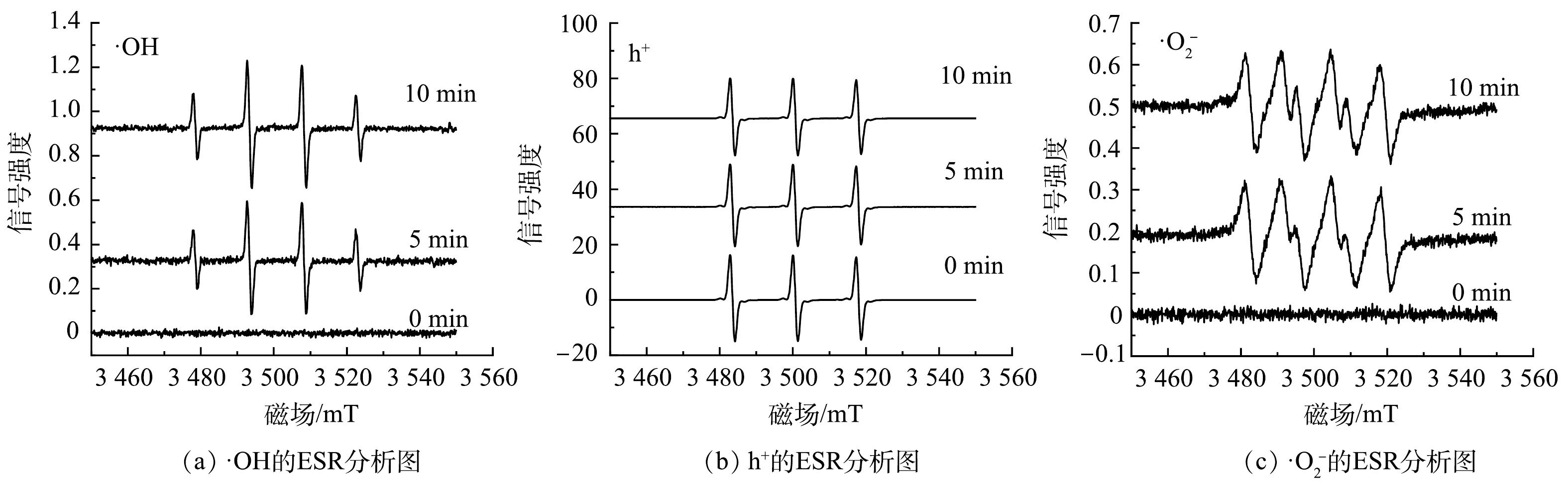
5)光降解活性物种鉴定。纳米TiO2在参与OTC、CTC光降解的过程中,会产生活性基团并进行电子转移(式(8)~式(10))。对纳米TiO2进行了电子顺磁共振光谱(ESR)测试,结果如图10所示。可见,在体系中检测到了DMPO-·OH、TEMPO-h+和DMPO-·O2−络合物的信号。这表明在纳米TiO2光降解OTC、CTC过程中生成了活性物种·OH、h+和·O2−。
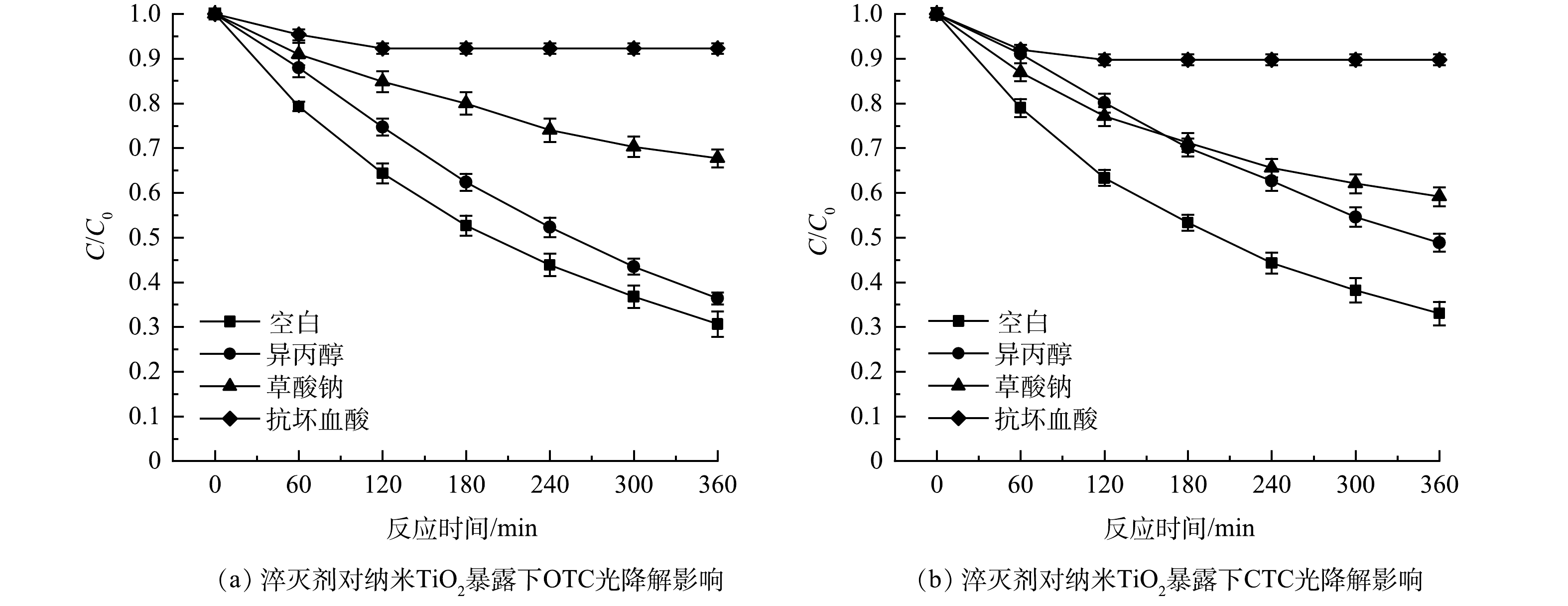
为确定参与反应主要活性基团的贡献率,设计自由基捕获实验。在OTC、CTC初始质量浓度为10 mg·L−1、纳米TiO2为50 mg·L−1、粒径为20~40 nm、淬灭剂浓度为5 mmol·L−1条件下,进行光降解反应,结果如图11所示。可见,在无淬灭剂情况下,纳米TiO2暴露下OTC、CTC的光降解率达到69.32%、66.92%;当体系中含有5 mmol·L−1 IPA时,OTC、CTC光降解率为61.90%、51.13%,仅略微降低,表明·OH并不是OTC、CTC光降解过程中最主要的活性基团;当体系中含有5 mmol·L−1 Na2C2O4时,OTC、CTC的光降解率明显降低,为32.29%、39.89%;而当体系中含有5 mmol·L−1 VC时,OTC、CTC的光降解率大幅降低,仅为7.74%和10.51%,表明在纳米TiO2暴露下的OTC、CTC光降解过程中,h+是贡献较大的活性基团,·O2−是最主要的活性基团。
不同淬灭剂存在体系中OTC、CTC的降解速率常数见表1,利用式(1)~(3)进行计算,在纳米TiO2暴露下的OTC、CTC光降解过程中,·OH贡献率分别为18.97%、40.03%,h+贡献率分别为65.15%、49.88%,·O2−贡献率分别为91.01%、87.35%。该结果表明相较于·OH,·O2−和h+在OTC、CTC光降解过程中发挥更重要的作用,活性物种贡献大小依次为·O2−>h+>·OH。
-
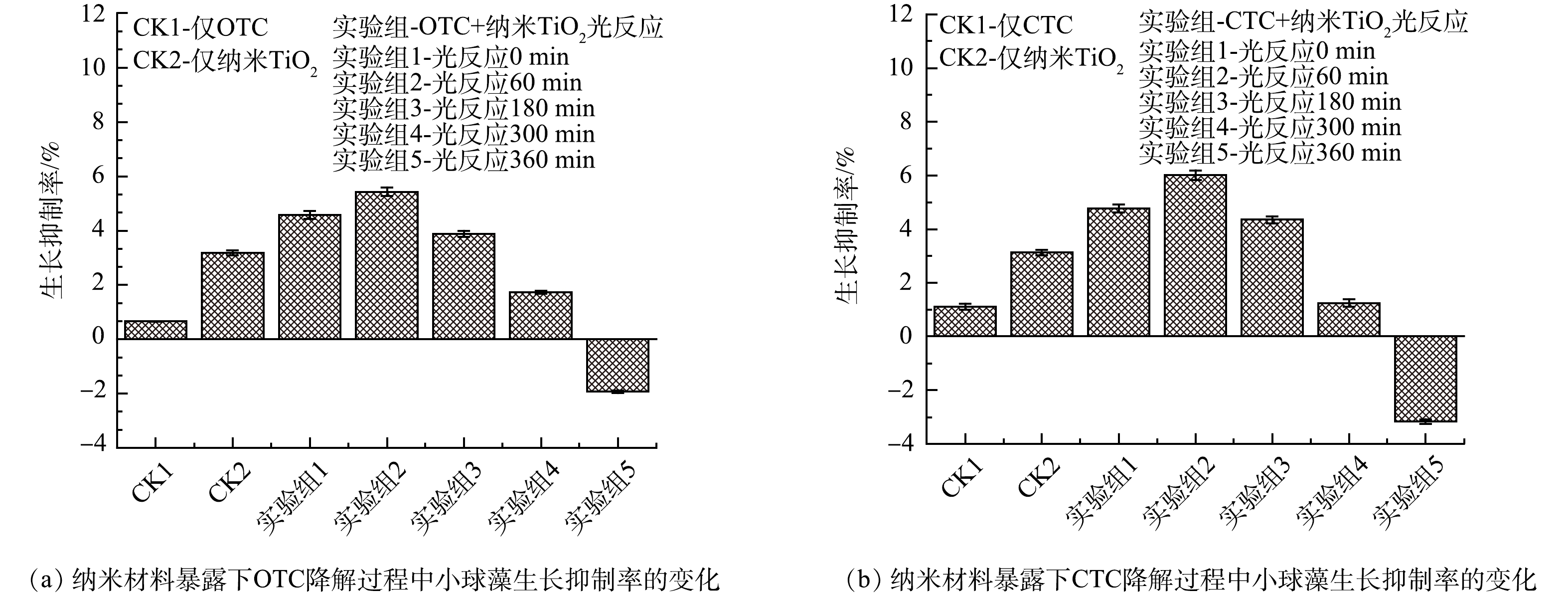
1)水质急性毒性研究。水生藻类是一种可以反映整个生态环境状况的生物,经常被用作水质指标和化学物质评价的指示剂。按照实验1.4方法测定不同组的小球藻生长抑制率以测定水质急性毒性,结果如图12所示。在纳米TiO2暴露下OTC、CTC光降解过程中,水体水质急性毒性发生明显变化,随反应时间的延长呈现先增大后减小的趋势,当暴露时间延长至180 min,水质急性毒性开始降低,当时间延长至360 min,纳米TiO2充分参与并促进了OTC、CTC光降解,水质急性毒性显著降低,甚至开始促进小球藻生长的水平。水质毒性变化的主要原因在于抗生素降解过程中生成的中间产物,在纳米TiO2与OTC、CTC光反应的前期生成了具有较高风险的中间产物,水质毒性升高;在光反应的中后期,一些高风险的中间产物被降解,此时水环境对于藻类生长较为适宜,表现为光反应360 min后毒性降低,这一现象在其他学者的研究中也同样出现[22-23]。因此,虽然纳米TiO2暴露初期水质急性毒性有所升高,但随暴露时间延长,是毒性降低的过程。
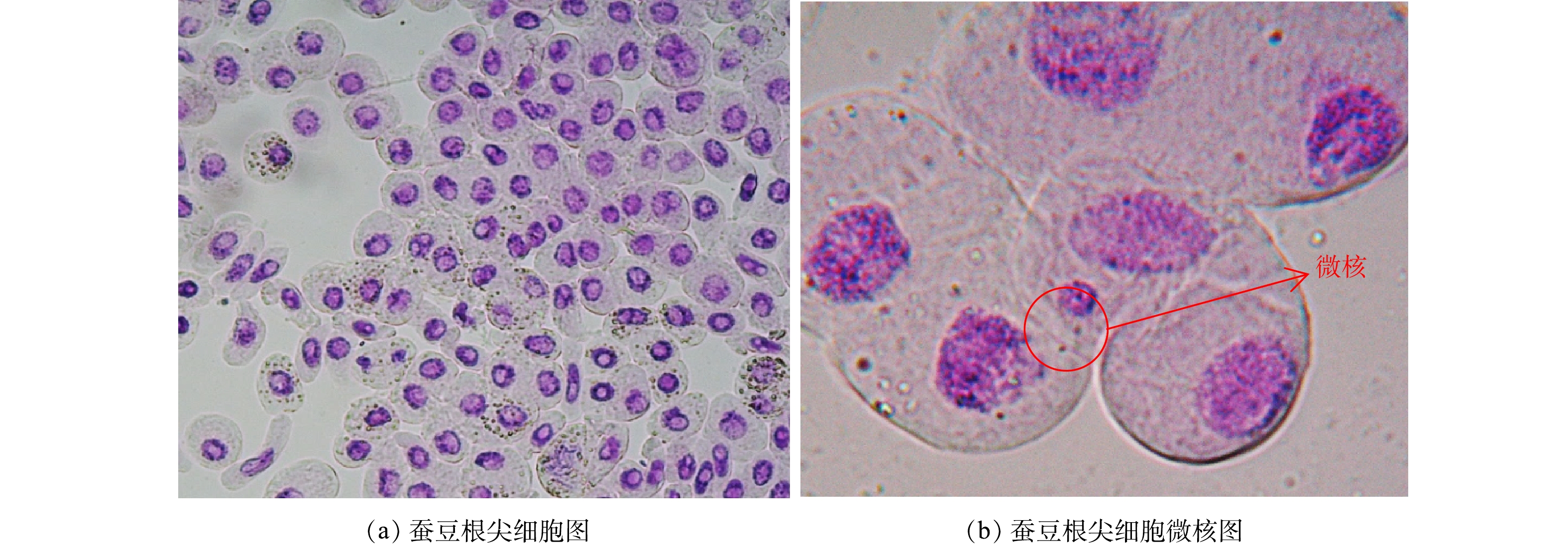
2)水质遗传毒性研究。蚕豆根尖在接触到污染物时,其分生区的细胞很容易受到损伤,从而形成微核(图13),因此可以利用蚕豆根尖分生区产生的微核数,对纳米TiO2暴露下OTC、CTC光降解反应前后的水质遗传毒性进行评估。
按照实验1.4方法,测定不同组的千分微核率和微核指数,并对不同组间进行显著性检验,计算结果如表2所示。空白对照自(OTC或CTC污染水体)的MCI值分别为3.88和4.13(p<0.01),远高于阴性对照组(纯水),表明OTC、CTC在水体中具有显著的遗传毒性。纳米TiO2暴露后,水质毒性增大,与空白对照组相比,OTC、CTC的MCN值分别上升了32.2%和30.3%,微核指数大于1.5,说明纳米TiO2与OTC、CTC同时暴露会显著增加水质遗传毒性,促进蚕豆根尖分生区细胞发生突变、产生微核。随暴露时间延长,水质遗传毒性逐渐升高,当暴露时间至360 min时,水质遗传毒性显著降低,OTC、CTC的MCN值较空白对照组分别降低了45.1%和42.4%。由此表明在纳米TiO2与OTC、CTC相互作用之初,抗生素母体化合物的性质结构未被破坏,但由于取代基发生了变化,使得蚕豆根尖细胞位阻降低,OTC、CTC更容易渗透到细胞中,导致水质毒性增加。随着光降解过程持续进行,OTC、CTC被逐渐分解,降解产物毒性较母体明显降低,水质毒性明显下降。总体而言,纳米TiO2暴露下OTC、CTC的光降解是解毒过程,纳米TiO2暴露初期,水质遗传毒性有所增加,随暴露时间延长,水质遗传毒性降低。
-
1)纳米TiO2暴露对OTC、CTC光降解有明显促进作用,在纳米TiO2投加量为50.0 mg·L−1、粒径5 nm、初始pH为6.0条件下,经360 min后OTC、CTC光降解效率均达95%以上,较未投加纳米TiO2体系提高6倍以上。
2)光降解过程中起主要作用的反应活性物种为·O2−,其对OTC、CTC光降解的贡献率可达91.01%、87.35%。
3)纳米TiO2暴露下,OTC、CTC光降解过程中急性毒性和遗传毒性随暴露时间呈现先增大后减小的趋势,表明纳米TiO2短期暴露可能导致复合毒性,但长期暴露后会促进OTC、CTC彻底光降解,降低水质毒性。
纳米TiO2暴露对水中四环素类抗生素光降解行为的影响
Effects of nano-TiO2 exposure on the photodegradation behavior of tetracycline antibiotics in aquatic environment
-
摘要: 本文研究了纳米二氧化钛(TiO2)暴露对水中土霉素(OTC)、金霉素(CTC)光降解行为的影响。结果表明:纳米TiO2暴露下OTC、CTC在模拟太阳光下的降解遵循准一级反应动力学模型,光降解效率随纳米TiO2投加量的增大、粒径的减小和初始pH的升高而逐渐提高。当纳米TiO2投加量为50.0 mg·L−1、粒径为5 nm,体系初始pH为6.0时,经360 min反应后 OTC、CTC光降解率分别为95.93%、97.13%。溶液中共存的HCO3−对光降解过程起促进作用,而Cl−起抑制作用。自由基捕获实验证明·O2−是OTC、CTC光降解过程中起主导作用的活性物种,光降解贡献率分别为91.01%、87.35%。通过毒性实验证明纳米TiO2长期暴露下可降低OTC、CTC的急性毒性和遗传毒性。Abstract: In this study, the effects of nanomaterial titanium dioxide (TiO2) exposure on the photodegradation behavior of oxytetracycline (OTC) and chlortetracycline (CTC) in the aquatic environment were investigated. The results showed that the photodegradation of OTC and CTC under nano-TiO2 exposure followed the quasi-primary reaction kinetic model, and the photodegradation efficiencies of OTC and CTC gradually increased with the increase of TiO2 dosage, the decrease of particle size and pH increase. When the dosage of nano-TiO2 was 50.0 mg·L−1, particle size was 5 nm and pH was 6.0, the photodegradation efficiencies of OTC and CTC were 95.93% and 97.13% after 360 min reaction, respectively. The coexisting HCO3− in solution promoted the photodegradation of OTC and CTC, while Cl− inhibited their photodegradation. Free radical capture experiments proved that ·O2− was the dominant active species in the photodegradation of OTC and CTC, and could account for 91.01% and 87.35% of the photodegradation, respectively. Through toxicity experiments, it has been proven that long-term exposure of nano-TiO2 can reduce the acute toxicity and genotoxicity of OTC and CTC.
-
Key words:
- nano titanium dioxide /
- oxytetracycline /
- chlortetracycline /
- photodegradation
-

-
表 1 不同淬灭剂存在体系中的降解速率常数
Table 1. Degradation rate constants in systems with different quenchers
淬灭剂 活性基团 降解速率常数/min−1 OTC CTC — — 3.38×10−3 3.25×10−3 IPA ·OH 2.74×10−3 1.95×10−3 Na2C2O4 h+ 1.18×10−3 1.63×10−3 VC ·O2− 3.04×10−4 4.11×10−4 表 2 OTC、CTC降解过程中蚕豆根尖微核率的变化
Table 2. Changes in micronucleus rate in Vicia Faba root tip during photodegradation of OTC and CTC
组别 反应时间/min 微核率(MCN‰) 微核指数(MCI) 阴性对照组 — 1.33 1.00 CK1(50 mg·L−1纳米TiO2) — 5.67 4.25** CK2(10 mg·L−1 OTC) — 5.17 3.88** CK2’(10 mg·L−1 CTC) — 5.50 4.13** 50 mg·L−1纳米TiO2与10 mg·L−1 OTC光降解反应 0 6.83 5.13** 60 10.17 7.63** 180 8.33 6.25** 300 4.50 3.38** 360 2.83 2.13* 50 mg·L−1纳米TiO2与10 mg·L−1 CTC光降解 0 7.17 5.38** 60 11.17 8.38** 180 8.83 6.63** 300 4.83 3.63** 360 3.17 2.38* 注:*表示相比阴性对照组在P<0.05水平有显著差异;**表示相比阴性对照组在P<0.01水平有显著差异。 -
[1] WANG X, JIA J, WANG Y. Combination of photocatalysis with hydrodynamic cavitation for degradation of tetracycline[J]. Chemical Engineering Journal, 2017, 315: 274-282. doi: 10.1016/j.cej.2017.01.011 [2] ALAVI N, BABAEI A A, SHIRMARDI M, et al. Assessment of oxytetracycline and tetracycline antibiotics in manure samples in different cities of Khuzestan Province, Iran[J]. Environmental Science and Pollution Research, 2015, 22(22): 17948-17954. doi: 10.1007/s11356-015-5002-9 [3] KüMMERER K. Antibiotics in the aquatic environment: A review Part I[J]. Chemosphere, 2009, 75(4): 417-434. doi: 10.1016/j.chemosphere.2008.11.086 [4] 叶林静. ZnO基磁性光催化材料的制备及其降解四环素类抗生素的研究[D]. 西安: 长安大学, 2014. [5] WANG C, LIN C Y, LIAO G Y. Degradation of antibiotic tetracycline by ultrafine-bubble ozonation process[J]. Journal of Water Process Engineering, 2020, 37: 101463 . [6] OAKES K D, SIBLEY P K, MARTIN J W, et al. Short‐term exposures of fish to perfluorooctane sulfonate: Acute effects on fatty acyl‐CoA oxidase activity, oxidative stress, and circulating sex steroids[J]. Environmental Toxicology and Chemistry, 2005, 24(5): 1172-1181. doi: 10.1897/04-419.1 [7] CUNNINGHAM V L, BINKS S P, OLSON M J. Human health risk assessment from the presence of human pharmaceuticals in the aquatic environment[J]. Regulatory Toxicology and Pharmacology, 2009, 53(1): 39-45. doi: 10.1016/j.yrtph.2008.10.006 [8] SHAO S, HU Y, CHENG J, et al. Research progress on distribution, migration, transformation of antibiotics and antibiotic resistance genes (ARGs) in aquatic environment[J]. Critical Reviews in Biotechnology, 2018, 38(8): 1195-1208. doi: 10.1080/07388551.2018.1471038 [9] HAN J, XU Y, XU D, et al. Mechanism of downward migration of quinolone antibiotics in antibiotics polluted natural soil replenishment water and its effect on soil microorganisms[J]. Environmental Research, 2023, 218: 115032. doi: 10.1016/j.envres.2022.115032 [10] ABRAMOVA A A, GRAKHOVA E V, ISAKOV V G. Migration of antibiotics in natural aquatic environment[J]. IOP Conference Series: Materials Science and Engineering, 2020, 962(4): 042076. doi: 10.1088/1757-899X/962/4/042076 [11] GOYNE K W, CHOROVER J, KUBICKI J D, et al. Sorption of the antibiotic ofloxacin to mesoporous and nonporous alumina and silica[J]. Journal of Colloid and Interface Science, 2005, 283(1): 160-170. doi: 10.1016/j.jcis.2004.08.150 [12] GHAUCH A, TUQAN A, ASSI H A. Antibiotic removal from water: Elimination of amoxicillin and ampicillin by microscale and nanoscale iron particles[J]. Environmental Pollution, 2009, 157(5): 1626-1635. doi: 10.1016/j.envpol.2008.12.024 [13] PETERSON J W, PETRASKY L J, SEYMOUR M, et al. Adsorption and breakdown of penicillin antibiotic in the presence of titanium oxide nanoparticles in water[J]. Chemosphere, 2012, 87(8): 911-917. doi: 10.1016/j.chemosphere.2012.01.044 [14] HARTMANN N B, BAUN A. The nano cocktail: Ecotoxicological effects of engineered nanoparticles in chemical mixtures[J]. Integrated Environmental Assessment & Management, 2010, 6(2): 311-313. [15] QI N, WANG P, WANG C, AO Y. Effect of a typical antibiotic (tetracycline) on the aggregation of TiO2 nanoparticles in an aquatic environment[J]. Journal of Hazardous Materials, 2018. 341: 187-197. doi: 10.1016/j.jhazmat.2017.07.046 [16] VARMA K S, SHUKLA A D, TAYADE R J, et al. Interaction of levofloxacin with reverse micelle sol-gel synthesized TiO2 nanoparticles: Revealing ligand-to-metal charge transfer (LMCT) mechanism enhances photodegradation of antibiotics under visible light[J]. Materials Letters, 2022. 309: 131304. doi: 10.1016/j.matlet.2021.131304 [17] 刘瑶, 苏雪筠. 二氧化钛光催化性能的影响因素分析[J]. 材料导报, 2004, 18(4): 4. [18] 赵雪辉. 改性TiO2对四环素类抗生素降解究[D]. 南京: 南京师范大学, 2015. [19] 张亚宣. Co-g-C3N4/La-TiO2制备及其可见光催化降解废水中四环素和环丙沙星的研究[D]. 南昌: 南昌大学, 2021. [20] 吴新民, 孙颖婷, 田培蓉. 废水中离子对改性TiO2催化剂降解盐酸四环素的影响[J]. 应用化工, 2016, 45(3): 450-452. [21] DIMITROVA N, DHIFALLAH M, MINEVA T, et al. High performance of PtCu@TiO2 nanocatalysts toward methanol oxidation reaction: from synthesis to molecular picture insight[J]. RSC Advances, 2019, 9(4): 2073-2080. doi: 10.1039/C8RA08782B [22] YUAN F, HU C, HU X, et al. Photodegradation and toxicity changes of antibiotics in UV and UV/H2O2 process[J]. Journal of Hazardous Materials, 2011, 185(2): 1256-1263. [23] 赵雪辉, 蒋彩云, 王玉萍. PVA-I修饰介孔TiO2光催化剂对盐酸四环素的光降解[J]. 环境工程学报, 2014, 8(10): 4060-4066. -




 下载:
下载: